
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法不正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 原子半径:r(A)<r(C)<r(B)
C. 甲、乙可能都具有漂白性
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
【答案】A
【解析】
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍,如A为O,则C为S元素,三种元素的原子序数之和为35,则B的原子序数为35-8-16=11,B为Na,由转化关系可知甲为Na2O或Na2O2,乙为SO2,丙为Na2S,结合对应物质的性质解答。
由以上分析可知A为O、B为Na、C为S,甲为Na2O或Na2O2,乙为SO2,丙为Na2S。
A.Na2O或Na2O2,与水反应生成氢氧化钠,Na2S为强碱弱酸盐,溶液都显碱性,但SO2与水反应生成酸,溶液显酸性,A错误;
B.O、S、Na中钠和硫为同周期元素原子,同周期元素的原子半径随原子序数的增大而依次减小,同主族元素从上到下原子半径逐渐增大,则原子半径大小:r(A)<r(C)<r(B),B正确;
C.甲如为Na2O2,具有漂白性,乙为SO2,也具有漂白性,C正确;
D.丙的水溶液在空气中长期放置,Na2S被O2氧化生成S,溶液可能会变浑浊,D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】混合物的分离方法①过滤,②蒸发,③蒸馏,④分液,⑤萃取,请从上面选择下列各混合物的分离方法(填序号)
(1)食盐水与泥沙______
(2)苯和水______
(3)蒸馏水的制取_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃:①CH3(CH2)2CH3、②CH3(CH2)3CH3、③(CH3)3CH、④(CH3)2CHCH2CH3,其沸点由高到低排列的顺序是( )
A. ②④①③B. ④②③①C. ④②①③D. ②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1) 固体残渣主要是含________元素的氧化物。
(2)写出Cr2O3与纯碱在高温焙烧时反应的化学方程式_______________________。
(3)高温焙烧后粉碎的目的是_____________________________,调节pH时形成的沉淀的成分是_______________________________________________。
(4)写出硫酸酸化使Na2CrO4转化为Na2Cr2O7的离子方程式 ______________________。
(5)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到Na2Cr2O7的转化,其原理如图所示。写出阳极的电极反应式____________________。
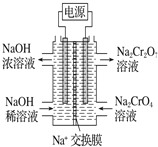
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为________________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是______________。(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,![]() ,
,![]() ,
,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g) ![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是( )
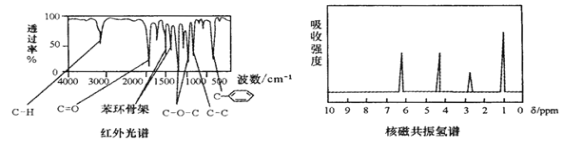
A. 由红外光谱可知,A中含有C-H键、C=O键、![]() 等
等
B. 由核磁共振氢谱可知,该有机物分子中有4种不同化学环境的氢原子
C. 若A的化学式为C8H8O2,则其结构简式可能为![]()
D. 由以上信息可以推测A分子可能为含有酯基的芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com