
分析 【探究实验】实验一:酸能使指示剂变红,维生素C俗称抗坏血酸,可能具有酸性,若将维生素C的滤液,滴到pH试纸显红色,说明其显酸性;
实验二:第一片苹果浸泡在蒸馏水中,蒸馏水中无还原性的物质,浸泡后在空气中易被氧气氧化,第二片浸泡在含维生素C的滤液中,维生素C被氧气氧化,体现还原性,保护苹果片被氧化;
实验三:碘单质与淀粉作用显示蓝色,维生素C能与碘单质发生氧化还原反应,维生素C体现还原性;
实验四:维生素C有还原性,能使酸性高锰酸钾溶液褪色;
【探究结论】
【知识联想】
(1)胃酸(HCl)分泌过多,服用含碳酸镁、碳酸氢钠的“胃得乐”,该类药物与维生素C不反应;
(2)由亚硝酸钠导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸钠中毒,则服用维生素C中某元素的化合价升高;
(3)防止食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,选项中的物质应具有还原性;
【提出建议】
维生素C具有还原性,蔬菜小火慢炒等,会让蔬菜的维生素C大幅度减少,在烹调时加点醋,有利于保护维生素C.
解答 解:【探究实验】
实验一:酸能使指示剂变红,碱能使指示剂变蓝,维生素C俗称抗坏血酸,可能具有酸性,取含维生素C的滤液,把滤液滴到pH试纸显红色,说明维生素C具有酸性,
故答案为:红;
实验二:取一个苹果,切出两小片,第一片苹果浸泡在蒸馏水中,蒸馏水中无还原性的物质,浸泡后取出放置于空气中,在空气中易被氧气氧化,苹果片变成褐色,第二片浸泡在含维生素C的滤液中,维生素被氧气氧化,保护苹果片被氧化,维生素C体现还原性,
故答案为:第一;还原性;
实验三:碘单质遇淀粉变蓝色,维生素C有还原性,能将碘单质还原为碘离子,蓝色褪色,
故答案为:蓝;蓝色褪色;
实验四:酸性KMnO4溶液有强氧化性,维生素C有还原性,两者作用高锰酸钾褪色,一支试管加入少量KMnO4溶液,再滴入煮沸过的滤液,观察到KMnO4溶液褪色,说明维生素C在100℃时仍存在,说明此时维生素C没有完全分解,
故答案为:不能;
【探究结论】
【知识联想】
(1)维生素C具有还原性,当体内胃酸分泌过多时,可以服用含碳酸镁、碳酸氢钠的“胃得乐”,这些药物不具有氧化性,两者不反应,能同时服用,
故答案为:能;
(2)亚硝酸钠导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,Fe元素的化合价升高,则亚硝酸钠表现了氧化性,服用维生素C可解除亚硝酸钠中毒,则服用维生素C中某元素的化合价升高,所以维生素C表现了还原性,
故答案为:还原性;
(3)A.生石灰具有吸水性,常用作干燥剂,不能防止食物被氧化,故A选;
B.还原铁粉具有还原性,在反应中Fe元素的化合价升高,能防止食物被氧化,故B不选;
C.亚硫酸钠+4价的硫具有还原性,在反应中硫元素的化合价升高,能防止食物被氧化,故C不选;
D.维生素C具有还原性,能防止食物被氧化,故D不选;
故答案为:A;
【提出建议】
A、洗涤蔬菜应先洗后切,防止维生素流失,故A不选;
B、维生素C高温时容易被破坏,蔬菜小火慢炒,会让蔬菜的维生素C大幅度减少,故B选;
C、维生素C又叫抗坏血酸,是一种还原性物质,在碱性条件下很容易遭受破坏,在烹调时加点醋,有利于保护维生素C,故C不选;
故答案为:B.
点评 本题探究了维生素C的有关知识,完成此题,可以依据题干提供的内容,抽取有用的信息,结合已有的知识进行解题,注意维生素C具有还原性的典型性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用CCl4可擦去圆珠笔油渍 | |
| B. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| C. | 煮鱼时加入少量食醋和料酒可除腥味,增加香味 | |
| D. | 小苏打可用作焙制面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
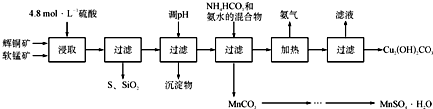
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
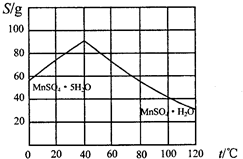
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量的发酵粉放在容器中加热,观察气体的产生 | |
| B. | 在洁净的水杯中先加入小苏打粉,再加入食醋,观察气体 | |
| C. | 往稀白粥中加入少量加碘食盐,检验加碘食盐中含有I2 | |
| D. | 在一瓣橘子上插入两根铜丝并与小灯泡连接,验证电流的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 目 的 | 化学试剂及方法 | 供选择的化学试剂及方法 A.加入硝酸酸化的硝酸银溶液 B.加入食醋,加热 C.灼烧、闻气味 D.加入新制氢氧化铜悬浊液,加热 E.将样品滴在淀粉碘化钾试纸上 |
| 除去热水瓶中的水垢 | ||
| 鉴别蔗糖和葡萄糖 | ||
| 验证味精中是否含有食盐 | ||
| 区别毛织物和棉织物 | ||
| 检验自来水是否含Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g O2 | B. | 0.3mol NaCl | ||
| C. | 标准状况下4.48L CH4 | D. | 含有3.01×1022个氧原子的H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 化学试剂或实验方法 |
| 检验HCl中是否含Cl2 | |
| 从海水中获取淡水 | |
| 将Br2从水中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com