
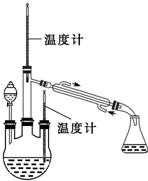
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl| 250 |
| 25 |
| 0.018mol×50g/mol |
| 5.00g |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| A、钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B、电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C、金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D、铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业合成氨:N2+3H2
| |||
B、工业合成盐酸:H2+Cl2
| |||
C、工业获取氯化钠:2Na+Cl2
| |||
D、工业制取氯气:2NaCl+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用化学平衡常数判断化学反应进行的快慢 |
| B、利用溶解度数据判断氧化还原反应发生的可能性 |
| C、利用沸点数据推测将一些液体混合物分离的可能性 |
| D、利用物质的摩尔质量判断相同状态下不同物质密度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
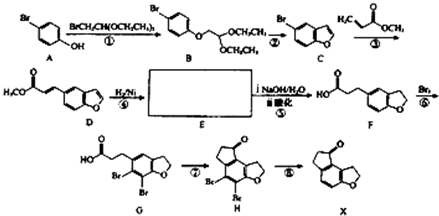
查看答案和解析>>
科目:高中化学 来源: 题型:
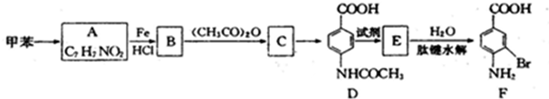
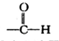 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
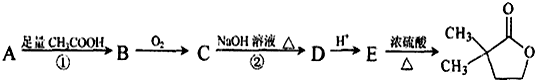
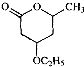 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从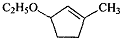 到
到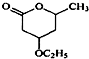 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).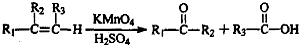 ;
;| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
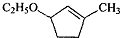
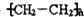 .
.
| H2O |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com