
分析 (1)硅酸盐的化学式可写成氧化物的形式,根据原子守恒从而找出a与b应满足的关系;
(2)硅酸盐的化学式可写成氧化物的形式,根据原子守恒从而找出a与b应满足的关系,根据a与b的取值范围判断;
(3)根据a、b的关系计算b值,从而确定该化学式.
解答 解:(1)硅酸盐Mg a(Si4O10)(OH)b以氧化物的形式表示为aMgO•4SiO2•$\frac{b}{2}$H2O,共用O原子守恒得:a+8+$\frac{b}{2}$=10+b,化简后得2a=b+4,故答案为:2a=b+4;
(2)硅酸盐Mg a(Si4O10)(OH)b以氧化物的形式表示为aMgO•4SiO2•$\frac{b}{2}$H2O,根据O原子守恒得:a+8+$\frac{b}{2}$=10+b,化简后得2a=b+4,且a、b都大于0,当a=2时,b=0,a能不能等于2,故答案为:不能;
(3)当a=3时,b=2,所以该硅酸盐的化学式为3MgO•4SiO2•H2O,故答案为:3MgO•4SiO2•H2O.
点评 本题考查了硅酸盐中硅酸盐与氧化物的相互书写换算,在书写时要注意原子守恒.


科目:高中化学 来源: 题型:选择题
| A. | 都是银白色金属,易导电、导热 | B. | 都具有还原性,都能置换酸中的氢 | ||
| C. | 都需要用电解法冶炼 | D. | 都能与其他金属或非金属形成合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ④③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
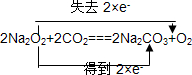 、
、 、2aOH+CO2=Na2CO3+H2O.
、2aOH+CO2=Na2CO3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 次序 | 稀盐酸(mL) | 余固体(g) |
| 1 | 先加入5.0mL | 1.32 |
| 2 | 再加入5.0mL | 0.64 |
| 3 | 再加入5.0mL | 0.20 |
| 4 | 再加入5.0mL | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ①④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com