

| A. | 该电池通过阳离子的移动,保持溶液中电荷平衡 | |
| B. | 电池工作时,电流表指示出从Zn极到Cu极的电流方向 | |
| C. | 电池工作过程中,乙池的c(SO42-)逐渐减小 | |
| D. | 电池工作一段时间后,甲池中溶液质量明显增大 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,以此解答该题.
解答 解:A.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,故A正确;
B.锌为负极,铜为正极,电流表指示出从Cu极到Zn极的电流方向,故B错误;
C.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故C错误;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故D错误.
故选A.
点评 本题考查原电池工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,题目比较基础,注意阳离子交换膜不允许阳离子通过,D选项利用电荷守恒分析.


科目:高中化学 来源: 题型:选择题
 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜右侧溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时交换膜左侧溶液中约减少0.01 mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该1体积盐酸中加入2体积水 | |
| B. | 将该1体积盐酸加水冲稀到3体积 | |
| C. | 将该盐酸与pH=12的氢氧化钠溶液以1:9的体积比混合 | |
| D. | 取该1体积盐酸加100体积水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
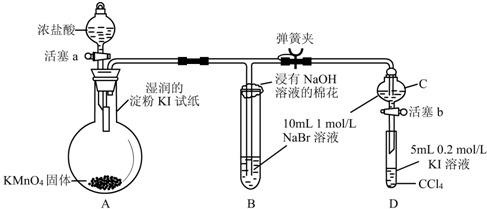
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4 | |
| B. | 电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小 | |
| D. | 蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
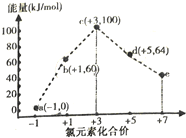
| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

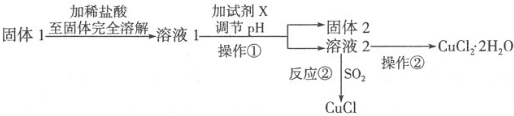
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com