AD
试题分析:根据盐的组成可知,溶质浓度相同时,硫酸铵溶液中的铵根离子浓度比氯化铵溶液中的大,而硫酸亚铁铵溶液中的铵根离子浓度比硫酸铵中小,因为亚铁离子的水解反应能抑制铵根离子的水解,则c(NH
4+):(NH
4)
2Fe(SO
4)
2>(NH
4)
2SO
4>NH
4Cl,反之,若三种铵盐溶液中c(NH
4+)相等,硫酸亚铁铵浓度保持不变时,则氯化铵浓度增大的程度最大,硫酸铵浓度增大的程度其次,所以溶质浓度大小关系为c[(NH
4)
2Fe(SO
4)
2]<c[(NH
4)
2SO
4]<c(NH
4Cl),故A选项正确;由于n=c?V,则HY和NaOH的物质的量相等,二者恰好完全中和,生成NaY溶液,由于溶液pH=9,即溶液显碱性,说明NaY是强碱弱酸盐、HY是弱酸,相同,由于c(H
+)=10
—pHmol/L=10
—9mol/L,K
w=c(H
+)?c(OH
-)=10
—14,则该碱性溶液中的溶液中c(OH
-)=K
w/c(H
+)=10
—5mol/L,由于NaY溶液中质子守恒关系式为c(OH
-)=c(H
+)+c(HY)= 10
—5mol/L,故B选项错误;强酸与强碱混合时强酸过量,则混合后溶液中c(H
+)=
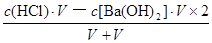
=
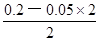
mol/L=0.05mol/L,由于pH="—lg" c(H
+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO
3=Na
++HCO
3—、H
2O

H
++OH
—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO
3—+ H
2O
![]()
H
2CO
3+OH
—、HCO
3—![]()
H
++ CO
32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H
+)+c(H
2CO
3)=c(CO
32-)+c(OH
-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及盐类水解程度大小关系、盐溶液中质子守恒关系式、溶液的pH、水的离子积等。

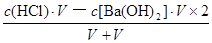 =
=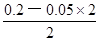 mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O
mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O
H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O

 阅读快车系列答案
阅读快车系列答案 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH




 (任写2种)
(任写2种) (任写2种)
(任写2种)


 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.




