
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
【答案】SiO2 4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O 99% 0.25 强酸性 Fe-6e-+8OH-=FeO42-+4H2O 阴 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600℃焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用,据此分析解答。
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用。
(1)矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵加热浸取后的浸渣为不反应和不溶于水的硫酸钙和二氧化硅,“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外,还含有SiO2;
(2)矿渣中部分FeO焙烧时与H2SO4及空气中的氧气反应生成Fe2(SO4)3和水,反应的化学方程式为4FeO+6H2SO4+O2=2Fe2(SO4)3+6H2O;
(3)当溶液中c(F-)=2.0×10-3mol·L-1时,Ksp(CaF2)=c(Ca2+)×c2(F-)= c(Ca2+)×(2.0×10-3mol·L-1)2=4.0×10-11,故c(Ca2+)=1.0×10-5mol/L,则除钙率为![]() 99%;
99%;
(4)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图象,最佳取值为0.25;在强酸性介质中“反萃取”能使有机相再生而循环利用;
(5)①电解时正极连接铁电极,为阳极,阳极上失电子在碱性条件下反应生成FeO42-,电极反应式为Fe-6e-+8OH-=FeO42-+4H2O;离子交换膜(b))允许氢氧根离子向Ⅲ移动,为阴离子交换膜;
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。次氯酸钠将氢氧化铁氧化生成高铁酸钠,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加的铁粉的物质的量(横坐标)的关系如图所示,AB段与BC段所需Fe的质量比为( )
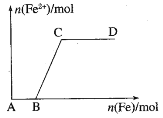
A.2:1B.1:2C.1:4D.3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.001 mol·L-1盐酸滴定0.001 mol·L-1 NaOH溶液的滴定曲线
B. 图2表示从能量角度考虑,石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中含大量Al3+
D. 图4所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,向
时,向![]() 溶液滴加入
溶液滴加入![]() 的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数
的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数![]() 随pH变化的关系如图2所示,下列表述正确的是
随pH变化的关系如图2所示,下列表述正确的是![]()

A.b点时,溶液中微粒浓度大小的关系:![]()
B.d点溶液垂直的关系:![]()
C.图2中的e点对应图1中的c点
D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是

A.溶液酸性:A>B>C
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2 =2Fe3++2H2O
C.向B溶液中滴加KSCN溶液,溶液可能会变为红色
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图(忽略体积变化)。下列说法正确的是( )
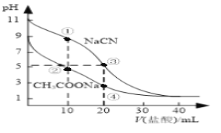
A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN-)+c(HCN)﹤2c(Cl-)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)>c(CH3COOH)
D. 点④所示溶液中:c(Na+)+c(CH3COOH)+c(H+)>0.10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)基态钙原子电子占据的最高能层符号是_________,其核外共有______种不同能量的电子。
(2)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(3)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_________;所含元素的电负性由大到小的顺序为_____________。
(4)三聚氰胺俗称“蛋白精”,其结构为:
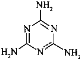
其中氮原子的杂化方式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下(20oC))课外小组用下列装置探究铁和硝酸反应情况,过程如下图所示:

将Ⅲ中液面上的气体排入小试管中点燃,有尖锐爆鸣声,小试管壁出现液滴。取反应后溶液,加入足量NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气带有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)X气体是______ (填化学式),证据是________。
(2)实验中硝酸被还原成另一种产物的化学方程式_____。
(3)甲同学对产生的气体原因提出假设并设计方案:
假设1:该浓度的硝酸中H+的氧化性大于NO3-
假设2:H+还原反应速率大于NO3-的还原反应速率
I. 验证假设1:可用____(选 “ Cu” 或“Zn”)粉与同浓度硝酸反应,依据 ____________ ,则假设1不成立。
II. 验证假设2:改变条件重复上图过程实验,结果如下:(所用试剂的量、气体成分与实验上图相同)
序号 | 反应温度 | 实验结果 |
a | 40oC | 溶液浅绿色,收集气体为3.4mL |
b | 60oC | 溶液浅绿色,收集气体为2.6mL |
上表实验结果_____(填“能”或“否”)判断假设2成立。由实验数据结果分析温度对铁粉与硝酸反应时对生成X体积的影响的原因___________。
(4)常温下(20℃),乙同学改用3mol·L–1 HNO3 进行图1过程实验,Ⅱ中仍为无色气体,在Ⅲ中气体变红色。由此得出的相关结论正确的是______ 。
a. 该实验产生的无色气体只有NO
b. 若改用浓硝酸时,反应会更剧烈还原产物为NO2
c. 硝酸的浓度不同时,其主要还原产物不同
(5)综上所述,金属与硝酸生成X气体,需要控制的条件是___________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com