
| A、1mol/L |
| B、2mol/L |
| C、3 mol/L |
| D、4 mol/L |
| 6.72L |
| 22.4L/mol |
| n |
| V |
| 6.72L |
| 22.4L/mol |
| 0.4mol |
| 0.1L |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
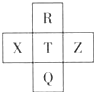 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:Z<T<X |
| B、R与Q原子核外电子数相差26 |
| C、气态氢化物稳定性:R<T<Q |
| D、最高价氧化物的水化物的酸性:X>T |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液与0.1mol?L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | ||
| B、0.1mol?L-1 NH4Cl溶液与0.1mol?L-1氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl-)>c(OH-) | ||
C、0.1mol?L-1 Na2CO3溶液与0.1mol?L-1 NaHCO3溶液等体积混合:
| ||
| D、0.1mol?L-1 Na2C2O4溶液与0.1mol?L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制饭勺、饭盒、高压锅等的不锈钢是合金 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
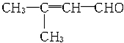 ,则该物质可能具有的化学性质为( )
,则该物质可能具有的化学性质为( )| A、①③④⑤ | B、②③④⑥ |
| C、①③⑤ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| O | - 4 |
| A、+1 | B、+2 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
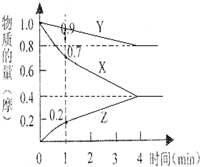 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
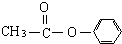 、
、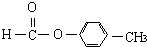 外还有四种,请分别写出结构简式:
外还有四种,请分别写出结构简式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com