
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
分析 A.硫单质点燃生成二氧化硫,二氧化硫通入硝酸钡溶液,溶液中形成稀硝酸氧化二氧化硫为硫酸,结合钡离子生成不溶于水和酸的硫酸钡沉淀;
B.二氧化硅不溶于水;
C.氯化镁晶体加热过程中会发生水解得到氢氧化镁沉淀;
D.氮气氧气放电件下反应生成一氧化氮;
解答 解:A.硫单质点燃生成二氧化硫,二氧化硫通入硝酸钡溶液,溶液中形成稀硝酸氧化二氧化硫为硫酸,结合钡离子生成不溶于水和酸的硫酸钡沉淀,转化关系可以一步实现,故A正确;
B.二氧化硅是酸性氧化物,但不溶于水不能一步生成硅酸,故B错误;
C.氯化镁晶体加热过程中会发生水解得到氢氧化镁沉淀,不能生成氯化镁固体,需要在氯化氢气流中加热失去结晶水得到氯化镁固体,故C错误;
D.氮气氧气放电件下反应生成一氧化氮,不能一步生成二氧化氮气体,故D错误;
故选A.
点评 本题考查了物质之间的转化,熟悉物质的性质是解题关键,注意反应条件和反应产物判断、氧化还原反应的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
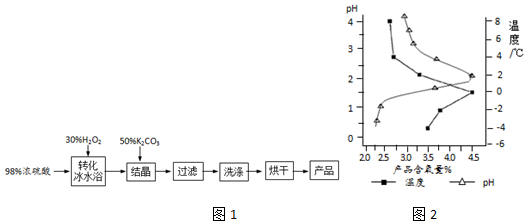
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将△H<0的氧化还原反应设计成原电池,将化学能转变为电能 | |
| B. | 轮船水线以下的船壳上,嵌一定数量的锌块,保护船体不被腐蚀 | |
| C. | 在锌与稀硫酸反应的溶液中加入少量CuSO4,能加快生成H2的速率 | |
| D. | 为了保护地下钢管不受腐蚀,将它与一定电压的直流电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由12C、16O、14N组成的44gCO2和44gN2O中含有的中子数均为22NA | |
| B. | 2L 0.5mol/L亚硫氢硫酸钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl时转移的电子数等于0.2NA | |
| D. | 适当条件下2molSO2与2molO2充分反应,反应体系中最终的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
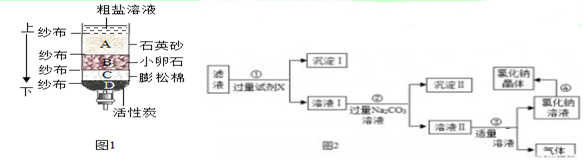
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图甲所示装置提纯氢氧化铁胶粒 | |
| B. | 用图乙所示装置进行中和热的测定 | |
| C. | 用图丙所示装置验证温度对平衡移动的影响 | |
| D. | 用图丙所示装置除去乙醇中的乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 放电过程 | 充电过程 |
| A | Li+向电池的正极迁移 | 化学能转化成电能 |
| B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-═FePO4+Li+ |
| C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
| D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-═Li |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com