
| A. | 溶液中导电粒子的数目减少 | |
| B. | 比值$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
分析 醋酸是弱电解质,CH3COOH?CH3COO-+H+,室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用酸碱混合时pH的计算来解答.
解答 解:A.弱电解质,浓度越稀,电离程度越大,醋酸溶液中加水稀释,促进电离,溶液中导电粒子的数目增多,故A错误;
B.醋酸的电离平衡常数Ka=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变,加水稀释时,醋酸根离子浓度减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B正确;
C.醋酸溶液中加水稀释,醋酸的电离程度增大,因溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,酸性减弱,故C错误;
D.等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
点评 本题考查了弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化关系是解答本题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
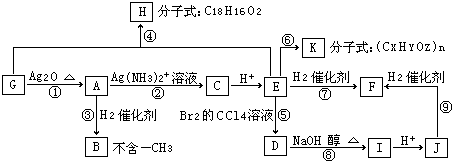
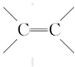 .
.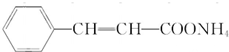 .物质K的结构简式
.物质K的结构简式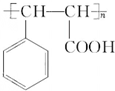 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算KCl所需的质量 | 需要的KCl质量为7.5g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是托盘天平、药匙 |
| (3)将KCl加入100mL的烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是搅拌、加热、研细氯化钾等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com