
【题目】下列反应中既属于氧化还原反应又属于放热反应的是( )
A.氢氧化钾与硫酸的反应
B.碳酸钙与盐酸反应放出二氧化碳
C.镁条在空气中燃烧
D.Ba(OH)2·8H2O与NH4Cl反应
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 
A.加入Na2SO4可以使溶液由a点变到c点
B.通过蒸发可以使溶液由d点变到c点
C.b、d点都是不能长时间稳定存在的点
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a.某有机物A化学式为CxHyOz,15 gA完全燃烧生成22 gCO2和9 gH2O。试确定:
(1)该有机物的最简式______________;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 _______________ ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为______________;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为_______。
b.有机物A、B、C、D在一定条件下有如图所示的转化关系:

请回答下列有关问题:
(1)写出B的分子式:____________________。
(2)分别写出反应①的反应方程式______________和②的反应方程式________________________
(3)③的反应类型为___________________________。
(4)两分子D在浓硫酸存在的条件下加热可以发生自身的酯化反应生成E或F,且E的相对分子质量比F的小,则E和F的结构简式分别为___________________、_________________。
(5)下列关于有机物A的说法正确的有__________________(填序号)。
a.含有氢氧根离子,具有碱性
b.能发生加聚反应
c.能使溴水褪色
d.在一定条件下能与冰醋酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 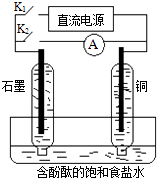
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入 25,.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点.
其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
① | 25.00 | 1.02 | 21.04 |
② | 25.00 | 2.00 | 22.98 |
③ | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
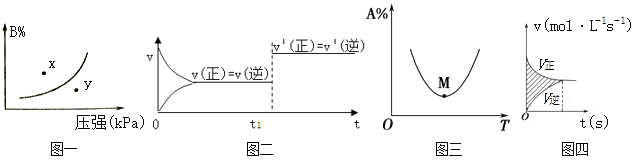
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com