
【题目】下列分子或离子①F- ②Na+ ③HF ④NH3⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌蓄电池应用广泛,放电时总反应为Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小组以银锌蓄电池为电源,用惰性电极电解饱和Na2SO4溶液制备H2SO4和NaOH,设计如图所示装置。连通电路后,下列说法正确是

A. 电池的a极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-
B. 气体Y为H2
C. pq膜适宜选择阳离子交换膜
D. 电池中消耗65gZn,理论上生成1mol气体X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
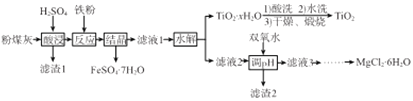
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
(1)“酸浸”时TiO2发生反应的离子方程式为_______________。
(2)“反应”时加入铁粉的作用为_______________。
(3)“结晶”需控制在70℃左右,温度过高会导致的后果为_____________。
(4)“水解”反应的离子方程式为______________。所得TiO2xH2O 沉淀进行酸洗的目的为____________。
(5)为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为________。
(6)实验室用MgCl2溶液制备MgCl26H2O,需进行的操作为_____、降温结晶、过滤、洗涤、干燥。
(7)FeSO47H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO47H2O的质量分数为____ (用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:
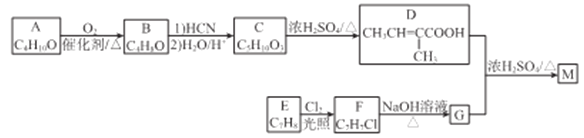
已知: (R1、R2表示烃基或H原子)
(R1、R2表示烃基或H原子)
请回答下列题:
(1)A的化学名称为_________,B的结构简式为________。
(2)C中官能团的名称为________。
(3)D分子中最多有___个原子共平面。
(4)E→F的反应类型为________。
(5)D+G→M的化学方程式为________。
(6)同时满足下列条件的D的同分异构体有___种(不考虑立体异构),其中核磁共振氢谱有3组峰的结构简式为________。
①能发生水解反应和银镜反应; ②不含环状结构
(7)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线_______________________。
的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
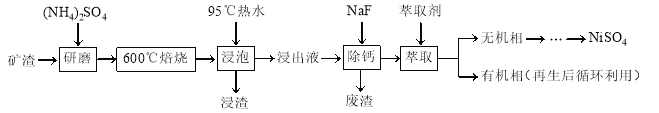
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为______________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有______________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为______________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
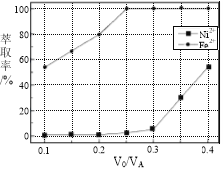
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
A.4 molL﹣1
B.0.2molL﹣1
C.2 molL﹣1
D.0.4 molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com