
【题目】(17分)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
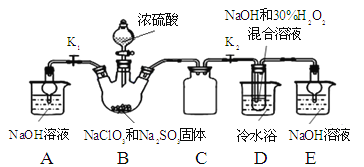
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
【答案】(17分)
(1)量筒 (2)防止D瓶溶液倒吸到B瓶中(或安全瓶)
(3)2ClO2 + 2NaOH + H2O2= 2NaClO2+ O2+ 2H2O
(4)NaClO3和NaCl
(5)用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃)
(6)a
(7)①溶液蓝色恰好褪去且半分钟内不复原 ②cV10-3
【解析】试题分析:(1)用50%双氧水配制30%的H2O2溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管、容量瓶,所以玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要量筒。
(2)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(3)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2ClO2 + 2NaOH + H2O2= 2NaClO2+ O2+ 2H2O,
(4) 由题目信息可知,应控制温度38℃~60℃, 高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl
(5)NaClO2饱和溶液在低于38℃时析出NaClO23H2O,从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,所以操作iii为用45℃左右的热水洗涤3遍。
(6)在B中可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2被带入D中,SO2与H2O2反应生成硫酸钠,a项正确;浓硫酸难挥发,不会进入D,b项错误;硫酸钠是难挥发的盐,也不会进入D,c项错误;选a。
(7)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;②令样品中NaClO2的物质的量x,根据化学反应可得关系式,
NaClO2~2I2~4S2O32-
1mol 4mol
0.25x c mol·L-1×V×10-3L
列方程解得x= cV10-3mol。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金。Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Cu基态原子核外电子排布式为________________。
(2)1 mol Ni(CO)4中含有σ键的数目为_______________。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是___________,与SO42-互为等电子体的分子为_______________。(填化学式)
(4) NH3的沸点_______________。(选填“高于”或“低于”)PH3,原因是_______________。
(5)某白铜合金晶胞结构如右图所示.晶胞中铜原子与镍原子的个数比为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第______周期第_______族。
(2)E元素形成的氧化物对应的水化物的化学式为______。
(3)元素B、C、D、E形成的简单离子半径大小关系是_________。(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:_________。
(5)由A、B、C三种元素形成的离子化合物的化学式为_________,它与强碱溶液共热,发生反应的离子方程式是_________。
(6) D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
_________。(化学式用具体的元素符号表示)。
(7)E的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的E的氧化物的含量。
 通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
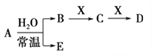
(1)元素⑧的最高价氧化物对应水化物的化学式是_________________________。
(2)元素⑤与As两种元素中,简单气态氢化物较稳定的是___________(填化学式)。
(3)元素②⑥⑦的简单离子半径由大到小的顺序是___________(用化学符号表示)。
(4)元素③的单质与元素②的最高价氧化物对应的水化物反应的离子方程式是________________。
(5)若A为红棕色气体,则X、D的化学式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g)![]() 2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是
A. CH3Cl B. CH2Cl2 C. CHCl3 D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
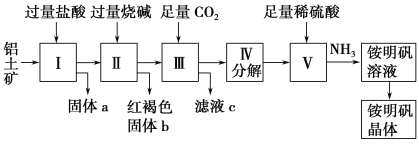
请回答下列问题:
(1)固体a的化学式为 ,Ⅲ中通入足量CO2气体发生反应的离子方程式为 。
(2)由Ⅴ制取铵明矾溶液的化学方程式为 ,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1 L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市红桥区2017届高三上学期期末考试】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com