
| A. | 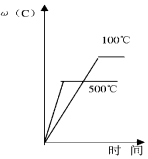 | B. | 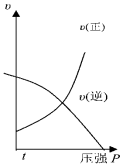 | C. | 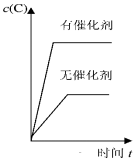 | D. | 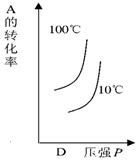 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | K+,Cl-,MnO4-,SO42- | B. | Na+,SiO32-,NO3-,CO32- | ||
| C. | Na+,NO3-,SO42-,HCO3- | D. | Na+,SO42-,S2-,ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
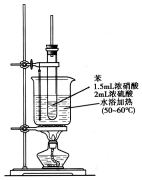 纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.
纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.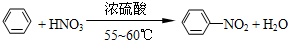 .
.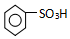 ),导致硝基苯的产率下降.写出发生副反应的化学方程式
),导致硝基苯的产率下降.写出发生副反应的化学方程式 +H2SO4(浓)$\stackrel{△}{→}$
+H2SO4(浓)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
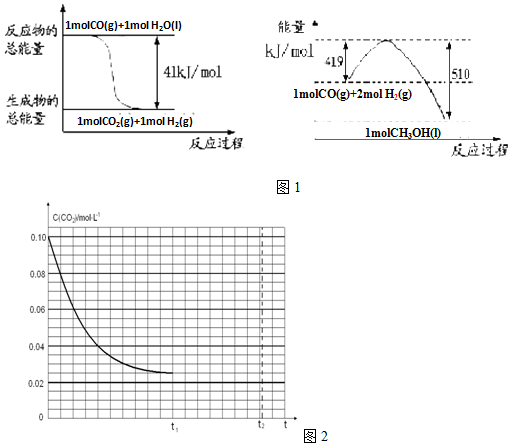
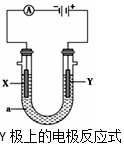 电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:
电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
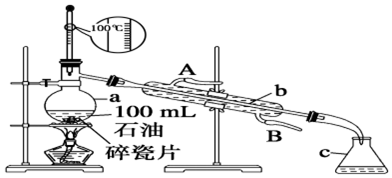
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com