


| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) | C1 | C2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
分析 Ⅰ(1)由能量图,可得:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3kJ•moL-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282kJ•moL-1
③$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-241.8kJ•moL-1
根据盖斯定律,①-③×3+②可得:CH4(g)+H2O(g)=CO(g)+3H2(g),反应热也进行相应计算;
(2)参与反应的氧气物质的量为 $\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒可知,生成二氧化碳为 $\frac{0.02mol×4}{8}$=0.01mol,n(NaOH)=0.1L×0.15mol•L-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所得溶液中n(Na2CO3):n(NaHCO3)=1:1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,钠离子浓度最大,由于水解程度不大,碳酸根浓度原大于氢氧根离子;
Ⅱ.A.t3时刻起反应物的转化率不变,说明到达平衡;
B.平衡常数与温度有关,温度不变,则平衡常数始终不变;
C.t1时刻NO与二氧化碳物质的量相等,而后NO物质的量减小、二氧化碳物质的量增大,故t1时刻反应向正反应进行;
D.起始n(NO):n(CO)=2:1,二者按1:1反应,随反应进行n(NO):n(CO)增大,二者之比不再变化,说明到达平衡;
Ⅲ.(1)甲与乙为完全等效平衡,平衡时同一物质的物质的量相同,则a+29.4=49;
(2)根据反应放出的热量计算消耗的二氧化碳物质的量,再根据v=$\frac{△c}{△t}$计算v(CO2).
解答 解:Ⅰ(1)由能量图,可得:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3kJ•moL-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282kJ•moL-1
③$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-241.8kJ•moL-1
根据盖斯定律,①-③×3+②可得:CH4(g)+H2O(g)=CO(g)+3H2(g),故△H=(-846.3+241.8×3+282)kJ•moL-1=+161.1kJ•moL-1,
故答案为:+161.1;
(2)参与反应的氧气物质的量为 $\frac{0.448L}{22.4L/mol}$=0.02mol,根据电子转移守恒可知,生成二氧化碳为 $\frac{0.02mol×4}{8}$=0.01mol,n(NaOH)=0.1L×0.15mol•L-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所得溶液中n(Na2CO3):n(NaHCO3)=1:1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钠离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
Ⅱ.A.随反应进行反应物转化率增大,t3时刻起反应物的转化率不变,说明到达平衡,故A正确;
B.平衡常数与温度有关,温度不变,则平衡常数始终不变,平衡常数不能说明到达平衡,故B错误;
C.t1时刻NO与二氧化碳物质的量相等,而后NO物质的量减小、二氧化碳物质的量增大,故t1时刻反应向正反应进行,故C错误;
D.起始n(NO):n(CO)=2:1,二者按1:1反应,随反应进行n(NO):n(CO)增大,二者之比不再变化,说明到达平衡,故D正确,
故选:AD;
Ⅲ.(1)甲与乙为完全等效平衡,平衡时同一物质的物质的量相同,则a+29.4=49,故a=19.6,
故答案为:19.6;
(2)甲中平衡时放出29.4kJ热量,则消耗的二氧化碳物质的量为$\frac{29.4kJ}{49kJ/mol}$=0.6mol,则v(CO2)=$\frac{\frac{0.6mol}{2L}}{10s}$=0.03mol/(L.min),
故答案为:0.03mol.
点评 本题考查化学平衡计算与影响因素、平衡状态特征、反应热计算、离子浓度大小比较等,题目涉及的知识点较多,需要学生具备扎实的基础,Ⅲ中(1)注意对规律的理解掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部是副族元素 | |
| B. | 周期表中的周期分为:短周期、长周期 | |
| C. | 周期表中的族分为:主族、副族、0族和VIII族 | |
| D. | 由短周期元素和长周期元素共同组成的族称为主族(除0族外) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
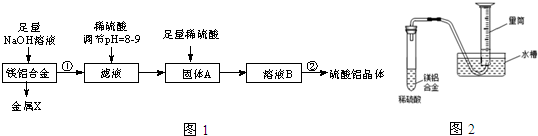
 ,固体A的化学式为Al(OH)3;
,固体A的化学式为Al(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体 | |
| D. | 工业上电解熔融的MgCl2,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com