
分析 n(Na2O2)=$\frac{15.6g}{78g/mol}$=0.2mol,结合2Na2O2+2H2O=4NaOH+O2↑、H2SO4+2NaOH=Na2SO4+2H2O计算.
解答 解:n(Na2O2)=$\frac{15.6g}{78g/mol}$=0.2mol,由2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气为0.2mol×$\frac{1}{2}$=0.1mol,其标准状况下体积为0.1mol×22.4L/mol=2.24L;
由Na原子守恒可知生成NaOH为0.4mol,由H2SO4+2NaOH=Na2SO4+2H2O可知,需要稀硫酸溶质的物质的量是0.4mol×$\frac{1}{2}$=0.2mol,
答:产生氧气标准状况下体积为2.24L,中和反应所生成的碱需要稀硫酸溶质的物质的量是0.2mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的相关计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
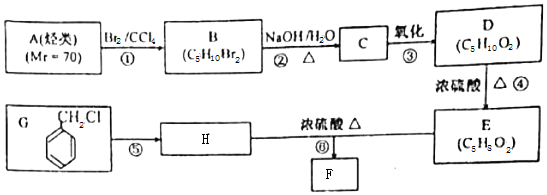
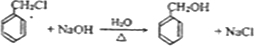 .
. .
.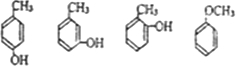 写出其中一种.
写出其中一种.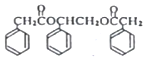 .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)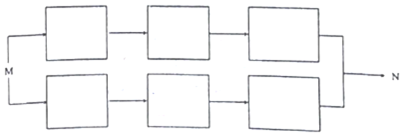
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
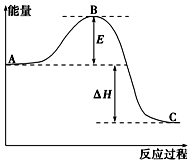 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H1 | B. | 2CO(g)+O2(g)═2CO2(g)△H2 | ||
| C. | S(s)+$\frac{3}{2}$O2(g)═SO3(s)△H3 | D. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
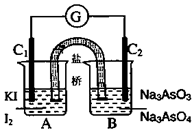 将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:
将AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为石墨棒.甲、乙两组同学分别进行下述操作:| A. | 甲组操作过程中,C1做正极 | |
| B. | 乙组操作过程中,C2做负极,电极反应式为:AsO33-+2e-+2OH-=AsO43-+H2O | |
| C. | 两次操作过程中,微安表(G)指针的偏转方向相反 | |
| D. | 甲组操作时该装置为原电池,乙组操作时该装置为电解池 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点、沸点:Li>Na>K>Rb>Cs | B. | 密度:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li>Na>K>Rb>Cs | D. | 还原性:Li>Na>K>Rb>Cs |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com