
| A. | 1:1 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
分析 乙烯和甲烷的混合气通入足量的溴水中,只有乙烯能与溴水反应,充分反应后,溴水的质量增加2.1g为乙烯的质量,利用n=$\frac{m}{M}$计算其物质的量,利用n=$\frac{V}{{V}_{m}}$来计算混合气体的总物质的量,进而计算原气体混合物中甲烷的物质的量,据此进行解答.
解答 解:溴水的质量增加2.1g为乙烯的质量,乙烯的物质的量为:n(C2H4)=$\frac{2.1g}{28g/mol}$=0.075mol,
混合气的总物质的量为:n(混合)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
混合气体中甲烷的物质的量为:n(CH4)=0.1mol-0.075 mol=0.025 mol,
原混合气体中乙烯与甲烷的物质的量之比=n(C2H4):n(CH4)=0.075:0.025=3:1,
故选B.
点评 本题考查混合物的计算,题目难度不大,注意乙烯与甲烷的性质的差异性,明确溴水增加的质量即为乙烯的质量是解答本题的关键,试题有利于提高学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

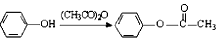
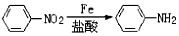
 .
.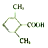 (或
(或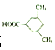 ).
).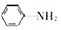 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物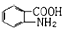 的合成路线
的合成路线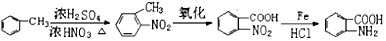 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
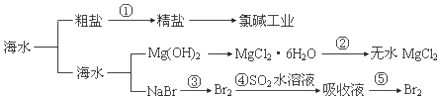
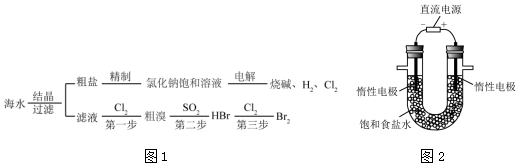
| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 工业生产中常选用石灰乳作为 Mg2+的沉淀剂 | |
| C. | 第②步的反应条件是:在空气中直接加热 | |
| D. | 第③步到第⑤步的目的是为了富集溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.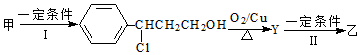
 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com