
能说明氯的非金属性比溴强的事实是( )
①共用电子对偏移程度:H-Cl > H-Br ②酸性:HClO4 > HBrO4
③热稳定性:HCl > HBr ④酸性:HCl <HBr
| A.①②③ | B.①②④ | C.②③④ | D.②③ |
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:单选题
以下比较中,正确的是 ( )
| A.微粒半径:F->O2->Na+>Li+ | B.电负性Cl>C ,酸性:HClO4>H2CO3, |
| C.分子中的键角:CH4>H2O>CO2 | D.稳定性:LiCl<NaCl<KCl<RbCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知,aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A.气态氢化物的稳定性:D>C
B.原子序数:B>A>C>D
C.最高价氧化物对应水化物的碱性:B>A
D.四种元素一定属于短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期Y元素的p轨道上有3个未成对电子,则该元素的最高价氧化物的水化物的化学式可能是
| A.H3YO4 | B.H4YO4 | C.HYO2 | D.H2YO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据下表信息,判断以下叙述正确的是( ) 部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.第三周期从左到右,各元素形成的简单离子半径逐渐减小 |
| B.共价化合物中一定含极性共价键,可能含非极性共价键 |
| C.第ⅦA族元素从上到下,其气态氢化物的稳定性和还原性均逐渐增强 |
| D.可能存在基态核外电子排布式为1s22s22p63s23p64s24p5的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“·”代表一种元素,其中起点O代表氢元素。下列说法中正确的是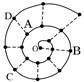
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.最简单氢化物的热稳定性:A>C>D
D.A、B两种元素组成的化合物中不可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是元素周期表的一部分,下列关系正确的是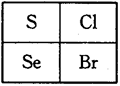
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com