
| A. | 物质的量为1mol | B. | 质量大于64g | ||
| C. | 含S原子数目大于NA | D. | 含O原子的物质的量小于2mol |
分析 常温常压下,气体摩尔体积不是22.4L/mol,气体摩尔体积大于22.4L/mol,依据n=$\frac{V}{{V}_{m}}$计算物质的量判断.
解答 解:A.常温常压下,气体摩尔体积不是22.4L/mol,物质的量不是1mol,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,22.4LSO2物质的量小于1mol,m=nM,质量小于64g,故B错误;
C.常温常压下,气体摩尔体积大于22.4L/mol,依据n=$\frac{V}{{V}_{m}}$计算物质的量可知物质的量小于1mol,含S原子数目小于NA、,故C错误;
D..常温常压下,气体摩尔体积大于22.4L/mol,依据n=$\frac{V}{{V}_{m}}$计算物质的量可知物质的量小于1mol,含O原子的物质的量小于2mol,故D正确;
故选D.
点评 本题考查了气体摩尔体积的应用条件分析,主要是气体摩尔体积和物质的量的计算应用,注意微粒数的计算,题目较简单.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 淀粉与20%的硫酸混合液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性 |
| C | 溴乙烷与NaOH溶液共热充分反应后,再加入AgNO3溶液,能观察到浅黄色沉淀 | 对,溴乙烷水解产生了溴离子 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
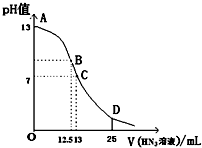 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )| A. | 若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂 | |
| B. | 常温下,向0.2mol•L-1HN3的溶液中加水稀释,则 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变 | |
| C. | 分别中和PH均为4的HN3溶液和HCl溶液,消耗0.1mol•L-1NaOH溶液的体积相同 | |
| D. | D点时溶液中离子浓度存在如下关系:c(H+)+c(HN3)=c(N3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 在氧气中点燃Mg条 | 发出耀眼白光,生成白色固体 |
| B | 将乙烯通入酸性高锰酸钾溶液 | 溶液褪色 |
| C | 将点燃的Na块伸入Cl2瓶中 | Na块剧烈燃烧,生成大量黑烟 |
| D | 将碘水滴到新切的土豆片上 | 土豆片表面变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com