
| A. | 人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(0H)3和O2可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-=CO2↑+H2O+NH3↑ |
分析 A.相对分子质量在10000以上的有机化合物为高分子化合物;
B.防氧化就是防止氧气的进入并与之反应,防受潮就是防止水分的进入;
C.Na2FeO4有强氧化性;
D.草木灰主要成分是K2CO3,混合使用的话NH4+和CO32-会发生双水解.
解答 解:A.人造纤维和合成橡胶相对分子质量较大,属于高分子化合物,故A正确;
B.在食品袋中放入盛有硅胶和铁粉的透气小袋,硅胶(具有吸湿性)能吸收水分,铁是较活泼的金属,具有还原性,能防止食品被氧化,故B正确;
C.Na2FeO4有强氧化性,能做消毒剂,水解生成氢氧化铁,能做净化剂,故C正确;
D.草木灰主要成分是K2CO3,混合使用的话NH4+和CO32-会发生双水解,2NH4++CO32-+2H2O?2NH3•H2O+H2CO3,故D错误.
故选D.
点评 本题考查了高分子化合物、食品添加剂以及盐类的水解等知识,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
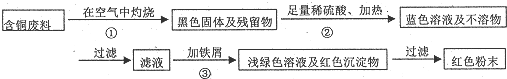
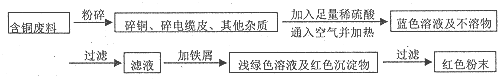
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若NO2与O2的体积比是4:3,则此溶液除了硝酸不含其他杂质 | |
| B. | 将一定量的Cu投入溶液中,只产生1.12L(标况)的红棕色气体,则反应的铜有1.6g | |
| C. | 将溶液在强光下光照,产生气泡,溶液变浅黄,产生气泡,则气泡是NO2 | |
| D. | 向浅黄的硝酸中通入氧气,可以使其pH值降低,溶液质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2C2O4溶液中,c(NH4+)=2c(C2O42-) | |
| B. | 等物质的量浓度的氨水和H2C204溶液等体积混合,所得溶液呈碱性 | |
| C. | pH=11的氨水和pH=3的H2C204溶液等体积混合,所得溶液呈酸性 | |
| D. | 用H2C204溶液中和氨水至中性时,溶液中c(NH4+)=2c(C2O42-)+c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
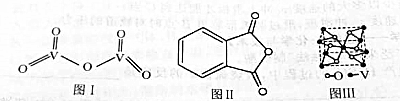
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
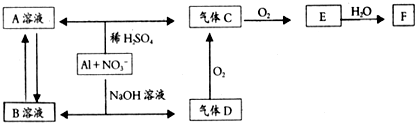

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com