
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
科目:高中化学 来源: 题型:
【题目】常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液中c(H+)最接近于( )
A. (10-8+10-10)mol·L-1B. (10-4+10-6)mol·L-1
C. (10-8+10-10)/2mol·L-1D. 2×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q五种元素,原子序数均小于36,它们的核电荷数依次增加,且核外电子数之和为54。X的激发态原子电子排布式为![]() ,Y原子的基态原子
,Y原子的基态原子![]() 能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)基态Q原子价电子排布式为_____。
(2)X、Y、Z、Q电负性由大到小排序为___(写元素符号)
(3)X与Z形成的化合物![]() ,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
(4)W的氯化物和![]() 的氧化物中,熔点较高的是____(填化学式),原因是_____。
的氧化物中,熔点较高的是____(填化学式),原因是_____。
(5)由X、Y组成的一种微粒结构如图![]() ,请写出该微粒的化学式:_____。
,请写出该微粒的化学式:_____。
(6)图(a)是![]() 的拉维斯结构,
的拉维斯结构,![]() 以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为
以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为![]() ,则
,则![]() 的密度是_____
的密度是_____![]() (列出计算表达式)。
(列出计算表达式)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 A 可以是_____(填序号,下同),其中①~⑧中的电解质有_____。
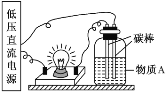
①干燥的氯化钠晶体 ②干燥的氢氧化钠固体 ③蔗糖晶体 ④酒精 ⑤NaHSO4 溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧Ba(OH)2 溶液
(2)向盛有⑧的溶液中,逐滴加入⑤,当溶液中的Ba2+恰好完全沉淀时,发生反应的离子 方程式为_________。
(3)某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO32-、NO3-。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入 BaCl2 溶液后,没有沉淀生成。
③另取少量溶液用硝酸酸化后,加入 AgNO3 溶液有白色沉淀生成。 根据上述实验推断:原溶液中肯定有__________离子,肯定没有_____离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述错误的是
A. 1mol月球表面的氦-3(![]() )含有质子为2NA
)含有质子为2NA
B. 1L![]() 的
的![]() 溶液中,含有0.1NA个
溶液中,含有0.1NA个![]()
C. 标准状况下,22.4L![]() 中所含分子数为NA
中所含分子数为NA
D. 标准状况下,1mol金刚石中含有的C-C键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列反应的化学方程式或离子方程式:
(1)钠在空气中燃烧:___;
(2)钠与水反应的离子方程式:___;
(3)碳酸钠转化为碳酸氢钠的化学方程式:___;
(4)碳酸氢钠溶液与氢氧化钠溶液反应的离子方程式:___;
(5)氯气和石灰乳反应化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式: ![]() ____、____、____、____、____、___、
____、____、____、____、____、___、
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:![]()
①该反应的氧化剂是____________氧化产物与还原产物的物质的量比是 __________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,28.80g金属单质A与1.20molCl2完成反应,生成1.20molAClx,则x=__________,若A原子核内质子数等于中子数,则A原子核内中子数为__________ ,氯原子结构示意图为____________。
(2)现有氨气3.4g,在标准状况下其体积为____________,含有氮原子的数目为_____ ;将气体全部溶于水,配成500mL溶液,该溶液的物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com