
(17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
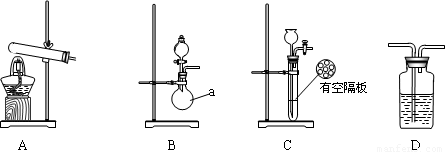
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
|
|
实验装置 |
实验药品 |
制备原理 |
|
甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为 ① 。 |
|
乙小组 |
② |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③ 。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是 。
:(1)圆底烧瓶(2分)(2)连接导管,将导管插入水中,加热试管,导管口有气泡产生,停止加热,导管内有水回流并形成一段稳定的水柱(3分)(3)①Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O
CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
【解析】:(1)写出仪器a是圆底烧瓶。(2)检查A装置气密性的操作是将导管接入盛水的水槽中,用水握住试管,有气泡产生,放手后能形成一段稳定的水柱,说明气密性良好。(3)①氢氧化钙和硫酸铵共热生成硫酸钙和氨气,方程式为Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O
CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO
NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO 3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
(5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小。要使没定值准确,只要找一种不吸收NH3的干燥剂即可,故可选用碱石灰。
考点定位:本题通过NH3和氨气中N、H原子个数测定来考查化学实验基础知识,涉及到仪器的识别、气密性的检查、实验误差解释、相关计算、实验评价及设计。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
(17分)
![]() 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验
![]()
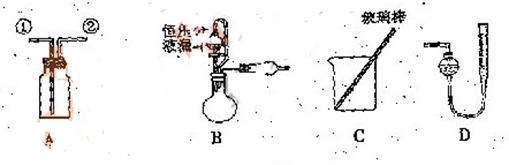
![]() 【实验一】收集NO气体。
【实验一】收集NO气体。
(1) ![]() 用装置A收集NO气体,正确的操作上 (填序号)。
用装置A收集NO气体,正确的操作上 (填序号)。
![]() a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
![]() c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
![]() 【实验二】为了探究镀锌薄铁板上的锌的质量分数
【实验二】为了探究镀锌薄铁板上的锌的质量分数![]() 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
![]() 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
![]() (2)选用B和 (填仪器标号)两个装置进行实验。
(2)选用B和 (填仪器标号)两个装置进行实验。
![]() (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况),![]() = 。
= 。
![]() (4)计算镀层厚度,还需要检索的一个物理量是 。
(4)计算镀层厚度,还需要检索的一个物理量是 。
![]() (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
![]() 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
![]() (6)
(6)![]() 。
。
![]() 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
![]() (7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是 ,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) ___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(四川卷带解析) 题型:实验题
(17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、硫酸、硫酸铵 | 反应的化学方程式为 ① 。 |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 。 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市海淀区高三下学期期中考试(理综)化学部分 题型:填空题
苏合香醇可以用作食用香精,其结构简式如图17所示。
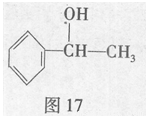
(1)苏合香醇的分子式为 ,它不能发生的有机反应类型有(填数字序号) 。
①取代反应 ②加成反应 ③消去反应
③加聚反应 ⑤氧化反应 ⑥水解反应
有机物丙是一种香料,其合成路线如图18。其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰乙;乙与苏合香醇互为同系物。 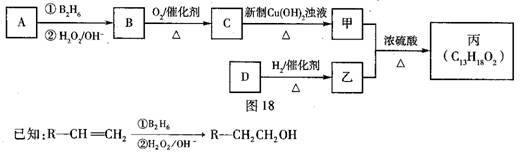
(2)按照系统命名法,A的名称是 。
(3)C与新制Cu(OH)2悬浊液反应的化学方程式为 。
(4)丙中含有两个—CH3在催化剂存在下1 mol D与2 mol H2反应可以生成乙,D可以发生银镜反应,则D的结构简式为 。
(5)甲与乙反应的化学方程式为 。
(6)苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有____种,其中3个取代基或官能团互不相邻的有机物结构简式为___ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com