
【题目】下列化合物中,不能由单质直接化合而得到的是( )
A.Fe3O4B.Na2O2C.FeCl2D.FeCl3
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如下图所示:
bM(g),M、N的物质的量随时间的变化曲线如下图所示:

(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b=______。
(2)若t2-t1=10 min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为_______mol/(L·min)。
(3)t1、t2、t3三个时刻中,______时刻达到反应的最大限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Ga元素因其在生产、生活和科研领域的重要作用而备受关注。
请回答下列问题:
(1)基态Ga原子中含有___________________种能量不同的电子,其中能量最高的电子的电子云轮廓图的形状为_________________________。
(2)Ga单质有晶体和玻璃体两种形态,区别二者最可靠的科学方法为_____________________。
(3)Ga分别与N、P、AS形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
物质 | GaN | GaP | GaAs |
熔点/℃ | 1700 | 1465 | 1238 |
①从结构的角度分析,三种晶体熔点不同的原因为____________________________________。
②GaN晶体中含有的化学键类型为______________(填选项字母)。
A.离子键 B.配位键 C.σ键 D.π键 E.氢键
③GaP的晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。若GaP晶体的密度为pg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为____________nm。
(4)第二周期元素中,基态原子的第一电离能大于基态氮原子的有__________种。
(5)NaNH2是一种重要的工业原料。
①钠元素的焰色反应为黄色。很多金属元素能产生焰色反应的微观原因为___________________。
②NH2-中氮原子的杂化方式为_____________;该离子的空间构型为________________。
③写出与NH2-互为等电子体的分子的化学式:____________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M为原子序数依次增大的短周期元素,周期表中X原子半径最小,Y元素形成化合物种类最多,Z元素的氢化物水溶液呈碱性,常温下L可以形成两种液态氢化物,M的最高价氧化物对应的水化物呈两性。回答下列问题:
(1)L元素形成单质的名称为______;M在元素周期表中的位置为____;五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为______。
(3)写出由X、Z、L三种元素组成的离子化合物与稀的NaOH溶液加热反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
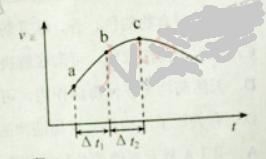
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
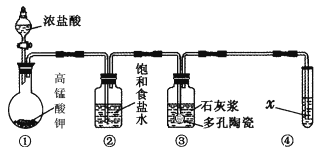
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
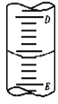
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )

A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 以下是实验室常用的部分仪器,请回答下列问题:
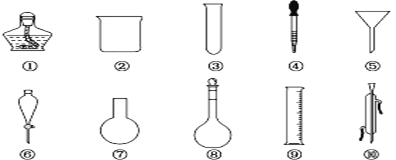
(1)序号为⑥和⑧的仪器的名称分别为__________________________。
(2)在分液操作中,必须用到上述仪器中的____________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的____________(填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是________(填序号)。
(5)仪器上标有温度的有____________(填序号)。
II.(1)指出下列实验仪器和用品(已洗涤干净)使用时的第一步操作:
①淀粉碘化钾试纸检验Cl2的性质_____________________________;
②分液漏斗(分液)__________________________________________。
(2)下列有关实验的叙述中,合理的是________。
A.用碱式滴定管量取25.00 mL溴水
B.测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,点在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
C.圆底烧瓶、锥形瓶、烧杯加热时都应垫上石棉网
D.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
E.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
G.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com