
下列表述正确的是
A.甲烷分子的球棍模型:
B.Cl的原子结构示意图: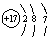
C.质子数是82,中子数是122的铅原子: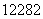 Pb
Pb
D.HCO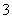 水解的离子方程式:HCO
水解的离子方程式:HCO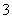 +H2O
+H2O H2CO3+H3O+
H2CO3+H3O+
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
X、Y、Z、R分别代表四种元素,如果aXm+、 bYn+、 cZn-、 dRm- 四种离子的电子层结构相同,则下列关系式正确的是( )
A、a-c=m-n B、a-b=n-m C、c+d=m+n D、b-d=n+m
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Cl2和SO2性质的叙述正确的是( )。
A.相同条件下,Cl2比SO2更易溶于水
B.在一定条件下,SO2比Cl2更易液化
C.常温下,等体积的Cl2和SO2混合气体通入BaCl2溶液时,无明显现象
D.等体积的Cl2和SO2分别通入含石蕊的水中,溶液的紫色立即褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )。
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )。
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上测量二氧化硫、氮气、氧气混合气体中二氧化硫含量的装置如下图所示,反应管中装有碘的淀粉溶液。二氧化硫和碘发生的反应为(氮气、氧气不与碘反应):
SO2+I2+2H2O==H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于________(填写化学式)的体积。
 (2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的二氧化硫含量________(填“偏高”“偏低”或“不受影响”)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的二氧化硫含量________(填“偏高”“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用________(填写物质名称)代替。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1,N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示二氧化硫的体积分数为________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为________(填下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
C.将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深
D.牺牲阳极的阴极保护法和外加直流电源的阴极保护法都是应用电解原理
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.向0.1 mol·L-1NH4Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)
C.已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者
D.浓度均为0.1 mol·L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,
c(NH )的大小顺序为:③>②>①
)的大小顺序为:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是 ( )
① C与O2 ② Na与O2 ③ Fe与Cl2
④ AlCl3溶液与NaOH溶液 ⑤ CO2与NaOH溶液 ⑥ Cu与硝酸
A.除⑥外 B.除③⑤外 C.除③④外 D.除③外
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
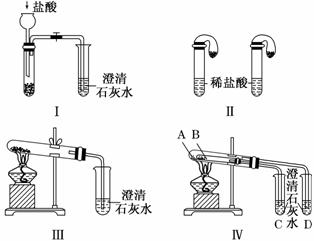
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方 程式:__________________;
程式:__________________;
与实验Ⅲ相比,实验Ⅳ的优点是__________(填选项序号)。
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全 C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com