
【题目】(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是______________。
(2)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水。已知E的分子式为C3H6O3,则:
①实验证实其中含有羟基,羧基,甲基,则E的结构简式为______________。
②写出E与足量Na反应的化学方程式_____________________________________。
③写出E与足量NaHCO3反应的化学方程式_________________________________。
【答案】产生砖红色沉淀![]()
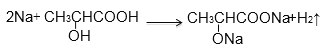 HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑
HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑
【解析】
(1)葡萄糖含有醛基,能被新制氢氧化铜悬浊液氧化,则检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是产生砖红色沉淀。
(2)①实验证实E分子中含有羟基,羧基,甲基,则根据E的分子式为C3H6O3可知E的结构简式为![]() 。
。
②羟基和羧基均能与钠反应产生气体,则E与足量Na反应的化学方程式为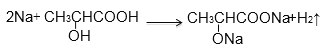 。
。
③羟基与碳酸氢钠不反应,羧基与碳酸氢钠反应放出二氧化碳,则E与足量NaHCO3反应的化学方程式为HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是

A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. c点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c (Na+)=3[c(CH3COOH)+c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用浓度为0.20mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。

(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数 | 待测液体积(mL) | 0.20mol·L-1的盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.70 | 20. 60 |
第一次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.10 | 21.10 |
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作不正确的是( )
A.分液时,分液漏斗内的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.1molL﹣1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH4+时,往试样中加入NaOH溶液,加热,用湿润蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应COCl2(g)![]() CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2浓度 C. 升温 D. 加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的“锂-呼吸CO2电池”,结构如图所示,下列说法不正确的是

A. 该装置是化学能转变为电能
B. 利用该技术可减少温室气体CO2的排放
C. 正极的电极反应为:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+从正极迁移至负极
【答案】D
【解析】A、该装置为原电池装置,将化学能转化为电能,故A正确;B、由图可知,CO2转化为C2O42-,可减少温室气体的排放,故B正确;C、CO2→C2O42-,碳元素化合价降低,得电子,则CO2在正极发生反应,电极反应为:2CO2 +2e-=C2O42-,故C正确;D、原电池中,阳离子向正极移动,故D错误。故选D。
【题型】单选题
【结束】
27
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2B.CO2和H2O
C.NaCl和HClD.CCl4和NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com