
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0,900 |
| 浓硫酸(98%) | - | 338 | 1.84 |


科目:高中化学 来源: 题型:
| A、沾附在试管内壁上的油脂,用热碱液洗涤 |
| B、蒸馏操作时应将温度计的水银球插入液面下 |
| C、苯酚有毒,若其浓溶液不慎沾到皮肤上,应立即用NaOH溶液冲洗 |
| D、向蔗糖溶液中加入几滴稀硫酸,水浴加热,再向其中加入银氨溶液,可产生银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | W | |
| A | C | Fe | NaCl | H2O |
| B | Pt | Cu | CuSO4 | CuSO4溶液 |
| C | C | C | H2SO4 | H2O |
| D | Ag | Fe | AgNO3 | AgNO3晶体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
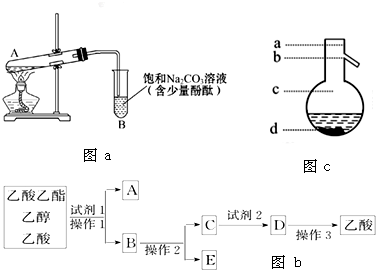
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.| 组序号 | 催化剂 | 反应现象 | C中饱和碳酸钠溶液中酯层高度 |
| ① | 2mL 98%浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐步加深,最后成黑色;酯层无气泡 | 2.10cm |
| ② | 2mL14mol?L-1 硫酸 | 反应后溶液呈浅棕色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.14cm |
| ③ | 2mL10mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠溶液界面清晰,没有气泡 | 2.16cm |
| ④ | 2mL7mol?L-1 硫酸 | 反应后溶液呈无色;酯层与饱和碳酸钠界面有气泡 | 2.00cm |
查看答案和解析>>
科目:高中化学 来源: 题型:
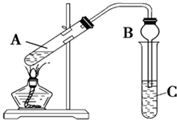
 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子的价电子构型为nsnnpn-1 |
| Y | Y的电负性在元素周期表中最强 |
| W | W的单质是人们将太阳能转换为电能的常用材料 |
| M | M原子的最外层有两个运动状态不同的电子 |
| N | N元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
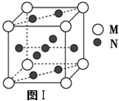 ,则该合金中M和N的原子个数比为
,则该合金中M和N的原子个数比为 ,其中M离子的配位数是
,其中M离子的配位数是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、催化剂因反应前后质量和化学性质不改变知催化剂不参加化学反应 |
| B、升温时不论吸热反应还是放热反应,速率都增大 |
| C、一定量的锌与过量的稀硫酸反应制取氢气,一定温度下为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液 |
| D、反应C(固)+H 2O(气)?CO(气)+H2(气)在一可变容积的闭容器中进行,当体积不变,充入N2,体系总压强增大使化学反应速率增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.44 L |
| B、6.72 L |
| C、2.8 L |
| D、5.6 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com