
| A. | 2.3gNa投入到97.7g水中形成的溶液溶质质量分数为4% | |
| B. | 25gCuSO4•5H2O溶于75g水之后,溶质的质量分数为16% | |
| C. | 相同质量的Na2O和Na2O2溶于相同体积的足量水中,所得溶液的质量分数相同 | |
| D. | 向含Na2CO310.6g的饱和碳酸钠溶液中通入过量CO2,所得溶液溶质质量为16.8g |
分析 A.2.3gNa的物质的量为0.1mol,反应生成4g氢氧化钠,但溶液的质量小于100g;
B.25 g CuSO4•5H2O物质的量为0.1mol,溶于75 g水之后,溶液质量为100g,含有硫酸铜0.1mol;
C.过氧化钠与水反应生成氢氧化钠和氧气,氧化钠与水反应生成氢氧化钠;
D.碳酸钠的溶解度大于碳酸氢钠,通入二氧化碳后有碳酸氢钠固体析出,导致碳酸氢钠的质量减小.
解答 解:A.2.3gNa的物质的量为0.1mol,反应生成4g氢氧化钠,但溶液的质量小于100g,所得溶液的质量分数大于4%,故A错误;
B.25 g CuSO4•5H2O物质的量为0.1mol,溶于75 g水之后,溶液质量为100g,含有硫酸铜0.1mol,所以硫酸铜溶液的质量分数为:$\frac{0.1mol×160g/mol}{100g}$×100%=16%,故B正确;
C.Na2O2溶于水后与水反应生成氢氧化钠和氧气,而氧化钠与水反应生成氢氧化钠,过氧化钠的摩尔质量为78g/mol,氧化钠的摩尔质量为62g/mol,则等质量时过氧化钠的物质的量减小,所得溶液中过氧化钠的质量分数减小,故C错误;
D.10.6g碳酸钠的物质的量为0.1mol,0.1mol碳酸钠与水反应生成0.2mol碳酸氢钠,质量为16.8g;由于碳酸钠的溶解度大于碳酸氢钠,则反应后溶液中碳酸氢钠的质量小于16.8g,故D错误;
故选B.
点评 本题考查了溶质质量分数的计算与判断,题目难度中等,明确溶质质量分数的概念及表达式为解答关键,D为易错点,注意碳酸钠的溶解度大于碳酸氢钠,试题培养了学生的化学计算能力.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
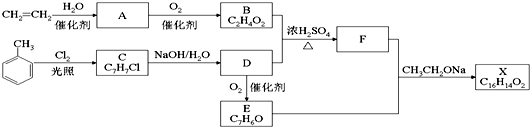
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ .B和D反应生成F的化学方程式
.B和D反应生成F的化学方程式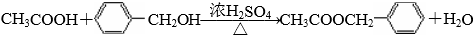 .D→E的化学方程式2
.D→E的化学方程式2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. .
. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.
COOCH2CH2CH3 D.CH2=CHCH=CHCH=CHCH=CHCOOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知条件 | 热化学方程式 | |
| A | 中和热为57.3kJ/mol | H2SO4(aq)+Ba(OH)2(aq)═ BaSO4(s)+2H2O(l) △H=-114.6kJ/mol |
| B | 合成氨反应生成0.1mol NH3时放出a kJ热量 | N2(g)+3H2(g)?2NH3(g) △H=-20a kJ/mol |
| C | H2的燃烧热为285.8kJ/mol | H2(g)+$\frac{1}{2}$O2(g)═H2O(g) △H=-285.8kJ/mol |
| D | 碳的燃烧热为393.5kJ/mol | 2C(s)+O2(g)═2CO(g) △H=-787kJ/mol |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com