
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)炭粉在高温条件下还原CuO易生成Cu;
(2)根据盖斯定律结合热化学方程式的书写方法来书写;
(3)在电解池的阳极发生失电子得还原反应;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)A、根据温度对化学平衡移动的影响知识来回答;
B、根据反应速率v=$\frac{△c}{△t}$来计算水蒸气的反应速率,速率之比等于化学方程式计量数之比;
C、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快.
解答 解:(1)炭粉在高温条件下还原CuO易生成Cu,反应不易控制,
故答案为:Cu;
(2)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-akJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-bkJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-$\frac{1}{2}$×①,反应的焓变是:△H=-(b-2c-$\frac{a}{2}$)KJ/mol,
故答案为:-(b-2c-$\frac{a}{2}$);
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
(5)A、实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高所以T2>T1,故A错误;
B、实验①前20min的平均反应速率 v(H2O)=$\frac{△c}{△t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7×10-5 mol•L-1 min-1,v(O2)=$\frac{1}{2}$ v(H2O)=3.5×10-5 mol•L-1 min-1,故B错误;
C、①②化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,②中水蒸气的浓度变化比①快,实验②比实验①所用的催化剂催化效率高,故C正确;
故答案为:C.
点评 本题是一道有关热化学、电化学以及化学反应速率和反应限度的综合题,考查角度广,注意基础知识的熟练掌握,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ•mol-1 | 159 | 418 | 946 | 391 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
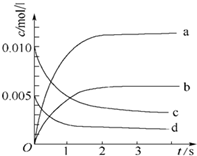 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
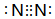 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com