
| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
分析 A.不符合离子的配比;
B.反应生成碳酸钠和水;
C.反应生成硫酸钠、水、二氧化碳;
D.反应生成碳酸氢钠.
解答 解:A.过量的NaHSO4和Ba(OH)2溶液反应的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B.NaHCO3和过量NaOH溶液相混合的离子反应为HCO3-+OH-═CO32-+H2O,故B正确;
C.NaHSO4溶液中滴加NaHCO3溶液的离子反应为H++HCO3-═H2O+CO2↑,故C正确;
D.用NaOH吸收过量的CO2的离子反应为CO2+OH-═HCO3-,故D正确;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
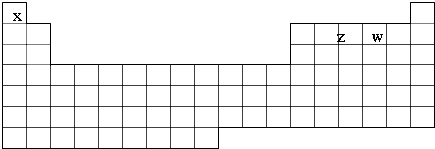
 X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
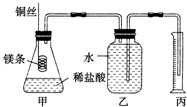 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
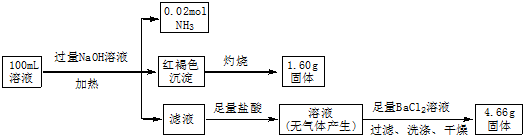
| A. | SO42-、NH4+和Na+ 一定存在,CO32-一定不存在 | |
| B. | SO42-、NH4+一定存在,Na+ 和CO32-一定不存在 | |
| C. | c(Fe3+)=0.1 mol•L-1 | |
| D. | c(Cl-)≥0.4mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com