
分析 ①n=CV;根据Cl原子守恒得c(Cl-)=c(HCl)+2c(CuCl2);
②向该溶液中加入足量Fe粉,Fe和氢离子及铜离子发生置换反应.
解答 解:①根据H原子守恒得c(H+)=c(HCl)=2mol/L,n(H+)=CV=2mol/L×0.1L=0.2mol;根据Cl原子守恒得c(Cl-)=c(HCl)+2c(CuCl2)=2mol/L+1mol/L×2=4mol/L,
故答案为:0.2;4;
②向该溶液中加入足量Fe粉,Fe和氢离子及铜离子发生置换反应,分别生成氢气和Cu,离子方程式分别为2H++Fe═Fe2++H2↑、Cu2++Fe═Cu+Fe2+,
故答案为:2H++Fe═Fe2++H2↑;Cu2++Fe═Cu+Fe2+.
点评 本题考查物质的量浓度有关计算及离子方程式书写,为高频考点,侧重考查学生分析判断及计算能力,灵活运用原子守恒是解本题关键,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
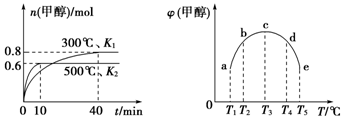
| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量固体HCl气体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com