
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
分析 X是周期表中原子半径最小的元素,应为H元素,Y的最高正价与最低负价绝对值相等,为C或Si元素,W最外层电子数是最内层电子数的3倍,为O或S元素,R是同周期元素中原子半径最小的元素,为F或Cl元素,X、Y、Z、W、R是原子序数依次增大的短周期主族元素,其中只有一种金属元素,则只有Z为金属,可为Na、Mg、Al等,则Y为C元素,W为S元素,R为Cl元素,以此解答该题.
解答 解:由以上分析可知X为H元素、Y为C元素,Z为Na、Mg、Al等元素,W为S元素,R为Cl元素,
A.同周期元素从左到右原子半径逐渐减小,则原子半径Z>W>R,故A正确;
B.非金属性R>W>Y,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.单质Z为活泼金属,可与Cl的最高价含氧酸发生置换反应生成氢气,故C正确;
D.氯离子不影响水的电离,故D错误.
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析、推断能力,明确元素周期律内涵即可解答,知道非金属性、金属性强弱判断方法,题目难度不大.


科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
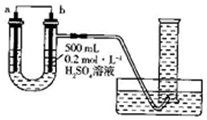 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )| A. | a电极的电极材料是铜 | |
| B. | 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 | |
| C. | 锌与稀硫酸反应时放出的热量对实验测定不产生影响 | |
| D. | 若量筒中收集到a L H2,则电解质溶液中通过了$\frac{a}{11.2}$mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )| A. | 简单离子的半径:W>Z>R | |
| B. | XR与XRZ均为强酸 | |
| C. | 化合物W2Z2中既含离子键又含极性键 | |
| D. | 图中转化过程发生的反应均为化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物沸点(℃) | -33.4 | 100 | 19.54 | -87.7 | -60.7 | -84.9 |
| 主要化合价 | +5 -3 | -2 | -1 | +5 -3 | +6 -2 | +7 -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W的最高价氧化物对应的水化物一定是强酸 | |
| B. | Z的单质一定能溶于稀硫酸中 | |
| C. | 四种元素的最高正化合价均等于其族序数 | |
| D. | 四种原子中,Z的原子半径最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com