
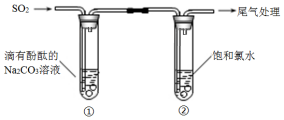
| A. | ①中溶液显红色的原因:CO32-+H2O?HCO3-+OH- | |
| B. | ①中溶液红色褪去的原因:2SO2+CO32-+H2O═CO2+2HSO3- | |
| C. | ②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO | |
| D. | ②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl |
分析 碳酸钠溶液显碱性,能使酚酞变红色,亚硫酸的酸性强于碳酸,在碳酸钠溶液中通入足量的二氧化碳发生反应2SO2+CO32-+H2O═CO2+2HSO3-,NaHSO3溶液显酸性,二氧化硫与氯水反应生成HCl和硫酸,即发生SO2+Cl2+2H2O═H2SO4+2HCl,据此分析.
解答 解:A.碳酸钠溶液显碱性,能使酚酞变红色,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-,故A正确;
B.亚硫酸的酸性强于碳酸,在碳酸钠溶液中通入足量的二氧化碳发生反应2SO2+CO32-+H2O═CO2+2HSO3-,NaHSO3溶液显酸性,所以溶液红色褪去,故B正确;
C.氯气溶于水部分与水反应,部分以氯气分子的形式存在于溶液,所以氯水显浅黄绿色是因为溶解了氯气,故C错误;
D.二氧化硫与氯水反应生成HCl和硫酸,即发生SO2+Cl2+2H2O═H2SO4+2HCl,氯气被消耗,所以溶液的黄绿色褪去,故D正确.
故选C.
点评 本题考查二氧化硫的化学性质探究、盐是水解原理,题目难度中等,明确二氧化硫的性质为解答关键,试题培养了学生的化学实验能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
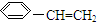 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 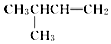 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 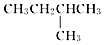 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
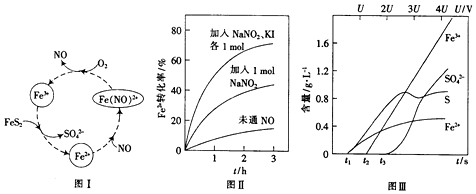
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
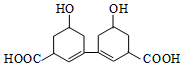 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
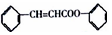 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
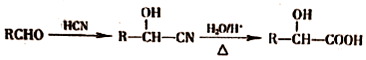
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种).
(任写一种).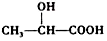 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | MgSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,旧键断裂放出能量,新键生成吸收能量 | |
| B. | 常温下,任何酸、碱间反应,每生成1mol水时的中和热都相同 | |
| C. | 放热反应在常温下都能自发进行 | |
| D. | 升高温度使活化分子百分数增大,反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com