
����Ŀ���ڻ���ƽ�����װ��ǿ��ԭ����(N2H4)��ǿ������(H2O2)�������ǻ��ʱ��������������N2��ˮ���������ų������ȡ���֪0.4molҺ̬�º�����H2O2��Ӧ�����ɵ�����ˮ�������ų�256.65kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ__________________________________________��
��2����֪H2O(l)=H2O(g)����H=+44kJ��mol-1����16 gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų���������________kJ��
��3��������ӦӦ���ڻ���ƽ��������ͷŴ������ȺͿ��ٲ������������⣬����һ����ͻ�����ŵ���________________________��
��4����֪N2(g)+2O2(g)=2 NO2(g)����H=+67.7 kJ��mol-1�� N2H4(g)+O2(g)= N2(g)+2H2O (g)����H=-534 kJ��mol-1�����ݸ�˹����д������NO2��ȫ��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ___________��
��5����֪�� ��N2 (g) �� 2O2 (g) �� 2NO2 (g) ��H = + 67.7kJ/mol
��N2H4 (g) ��O2 (g) �� N2(g) ��2H2O (g) ��H = -543kJ/mol
��1/2H2 (g) �� 1/2F2 (g) �� HF (g) ��H = -269kJ/mol
��H2 (g) �� 1/2O2 (g) �� H2O (g) ��H = -242kJ/mol
������Ϊ���÷������������������������Ӧ�ͷ����������ºͷ���Ӧ���Ȼ�ѧ����ʽ�� ��
��6������ȼ�տ���ͨ����������;����
;��I��C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ��H��-a kJ��mol-1
;��II��C3H8(g) ==C3H6(g)+ H2(g) ��H��+b kJ��mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ��H��-c kJ��mol-1
2H2(g)+O2 (g) == 2H2O(l) ��H��-d kJ��mol-1 (abcd��Ϊ��ֵ)
��ش�����������
�жϵ����ı���ͨ������;���ų���������;��I�ų������� ______(������������������������С����);��II�ų�������������C3H8(g) ==C3H6(g)+ H2(g) �ķ�Ӧ������Ӧ����е�������______(������������������������С����)��������е���������
b ��a��c��d����ѧ��ϵʽ��______________��
���𰸡���1��N2H4(l)+2 H2O2 (l) = N2(g)+ 4 H2O (g) ��H= - 641.625 kJ��mol-1 (2��)
��2��408.8 (1��)
��3������N2��H2O���Ի�������Ⱦ(1��)
��4��2N2H4(g)+2 NO2 (g) = 3N2(g)+4 H2O(g)����H= - 1135.7kJ��mol-1 (2��)
��5��N2H4(g)+2F2(g)=N2(g)+4HF (g)��H=-1135kJmol-1(2��)
��6������(1��) ��(1��) b=+![]() -a (2��)
-a (2��)
��������
�����������1��0.4molҺ̬���������������ⷴӦ�����ɵ�����ˮ�������ų�256.65kJ��������32g��ȼ�շ���641.625kJ����ȼ�յ��Ȼ�ѧ����ʽΪ��N2H4(l)+2H2O2(l)�TN2(g)+4H2O(g)��H=-641.625kJ/mol��
��2����N2H4(l)+2H2O2(l)�TN2(g)+4H2O(g)��H=-641.625kJ/mol��
��H2O(l)�TH2O(g)��H=+44kJ/mol��
���ݸ�˹��������-����4�õ���N2H4(l)+2H2O2(l)�TN2(g)+4H2O(l)��H=-817.625kJ/mol
��16gҺ̬��������Һ̬�������ⷴӦ���ɵ�����Һ̬ˮ����ʱ408.8KJ��
��3����ȼ�����ɵ�����ˮ�����ͷŴ����ȺͿ��ٲ������������������ɵ���������Ⱦ��
��4����N2(g)+2O2(g)�T2NO2(g)����H=+67.7KJmol-1��
��N2H4(g)+O2(g)�TN2(g)+2H2O (g)����H=-534KJmol-1
������ʽ2��-����2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)��H=2(-534KJmol-1
)-(+67.7KJmol-1)=-1135.7kJmol-1��
��5����N2H4(g)+O2(g)=N2(g)+2H2O(g)��H=-543kJmol-1
��1/2H2 (g) �� 1/2F2 (g) �� HF (g) ��H = -269kJ/mol
��H2(g) �� 1/2O2(g) �� H2O (g) ��H = -242kJ/mol
���ݸ�˹������-����2+����4�õ���N2H4(g)+2F2(g)=N2(g)+4HF (g)��H=-1135kJmol-1��
��5�����ݸ�˹������ú��Ϊȼ�ϲ�����һ����ɻ��Ƿ������������Ӧ��Ͳ������ֵ��һ������������;�����ʱ�ֵһ�����ų�������һ����
����C3H8(g)�TC3H6(g)+H2(g) �ķ�Ӧ����H��0���÷�Ӧ�����ȷ�Ӧ����Ӧ����е�������С���������������
;��I����C3H8(g)+5O2(g)�T3CO2(g)+4H2O(l)��H=-a kJmol-1
;��II����C3H8(g)�TC3H6(g)+H2(g)��H=+b kJmol-1
��2C3H6(g)+9O2(g)�T6CO2(g)+6H2O(l)��H=-c kJmol-1
��2H2(g)+O2 (g)�T2H2O(l)��H=-d kJmol-1 ��Ӧ��=��Ӧ��+��Ӧ����+��Ӧ����������-a=b+(-c-d)������b=-a+(c+d)��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨ��ʽ��ϩ���ᣩ��Fe2+�γɵ����������������ֳơ���Ѫ����������������ȱ����ƶѪ�������Ǻϳɸ���������һ�ֹ���·�ߣ�

�ش��������⣺
��1��A�Ļ�ѧ����Ϊ ����A����B�ķ�Ӧ����Ϊ ��
��2��C�Ľṹ��ʽΪ ��
��3��������Ľṹ��ʽΪ ��
��4�����鸻Ѫ�����Ƿ���Fe3+��ʵ����������� ��
��5��������Ϊ��Ԫ���ᣬ1mol����������������NaHCO3��Һ��Ӧ�ɷų� L CO2
����������������ͬ���칹���У�ͬΪ��Ԫ����Ļ��� �� ��д���ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3��NaHCO3�Ƚ��У�����˵������ȷ����
A. NaHCO3�����������ֽ⣬��Na2CO3�������Ȳ����ֽ�
B. ��������Na2CO3��NaHCO3�ֱ������������ᷴӦ��ǰ��������������ʵ����Ⱥ��߶�
C. �����ʵ���Ũ�ȵ�Na2CO3��NaHCO3��Һ�ֱ�μ�2�η�̪��Һ��ǰ����ɫ�Ⱥ�����
D. Na2CO3��Һ��NaHCO3��Һ�ֱ���Ba(OH)2��Һ��Ӧ�����ӷ���ʽ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������,��Ŀǰ����ˮ���塱������Ҫ����֮һ���乤��������ͼ��ʾ,���в���ȷ����
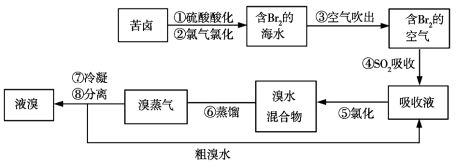
A���������ڱ���λ�ڵ������ڵ���A��
B��������˵������лӷ���
C�������������ӷ���ʽΪBr2+SO2+H2O![]() 2H++2Br-+S
2H++2Br-+S
D����������������������õ�Һ������ˮ�Ļ������÷�Һ©������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��C��N�Ǽ��ֳ����ķǽ���Ԫ�أ����γɵĸ��ֻ���������Ȼ���й㷺���ڡ�

��1����̬��ԭ�ӵĵ����Ų�ʽΪ_________��C��NԪ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ_________��
��2��BF3��һ������ˮ���γ���ͼ1�ľ���R��
������R�и���������������漰_________������ĸ����
a�����Ӽ� b�����ۼ� c����λ�� d�������� e�����»���
��R�������ӵĿռ乹��Ϊ_________��
��3���Ҷ�����H2N-CH2-CH2-NH2����CaCl2��Һ���γ����������ṹ��ͼ2���Ҷ��������е�ԭ�ӵ��ӻ�����Ϊ_________���Ҷ��������װ�[N��CH3��3]������泥����Ҷ��������װ��ķе�ߵö࣬ԭ����__________________��
��4����������BN�������ж�����ṹ�������൪������ͨ�����ڵ��ȶ��࣬��ṹ��ʯī���ƣ����в�״�ṹ�����������������ľ���ṹ��ͼ3��ʾ�������൪�����ʵ�����ԭ����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ����̬�⻯�ﻯѧʽΪH2R����������������Ӧ��ˮ���ﻯѧʽΪ�� ��
A. H2RO3 B. H2RO4 C. HRO3 D. H3RO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ�����һ���г�������ζ����ɫ���壬��ȼ�������£��ں����ܱ������У���CO��H2S��1:1��ϼ��ȿɵõ��ʻ�����������ָ������£�������ѹǿ���ڷ�Ӧǰ��ѹǿ������˵������ȷ����
A������Ӧ����ת��0��2mol���ӣ�������0��1mol�ʻ���
B��CO��H2S�ķ�Ӧ�У�H2S����ԭ��
C���ʻ���Ļ�ѧʽΪCOS����һ�ֹ��ۻ�����
D��1mol�ʻ�����ȫȼ�գ�����1��5mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ڷǽ���Ԫ�ص�ԭ�Ӻ��������������Ǵ�����������һ�룬���ڸ�Ԫ�ص�˵����ȷ���ǣ� ��
A. ����Ȼ���м��л���̬��������̬
B. ���ʳ������뵼�����
C. ��̬�⻯����ȶ�
D. ��������ﲻ���κ��ᷴӦ�����ƹ��ά
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��2H2(g)+O2 (g)![]() 2H2O(l)�� ��H=��571.6kJmol��1�������й���������ȷ������ ��
2H2O(l)�� ��H=��571.6kJmol��1�������й���������ȷ������ ��
A��2mol H2��ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
B��1mol H2��ȫȼ������Һ̬ˮʱ�ų�285.8kJ����
C��2���������ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
D�������Ȼ�ѧ����ʽ�ɱ�ʾΪH2(g)+![]() O2(g) = H2O(l)�� ��H=��285.8 kJmol��1
O2(g) = H2O(l)�� ��H=��285.8 kJmol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com