
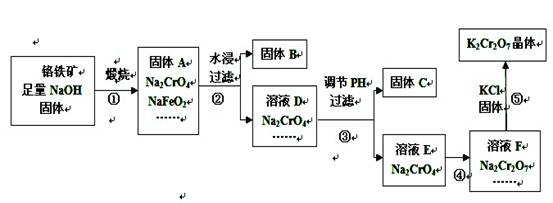
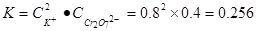 ,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,
,由于在同一温度下,所以K相同,根据K+离子浓度可以计算出Cr2O72-浓度的最大值,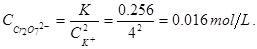


科目:高中化学 来源:不详 题型:填空题
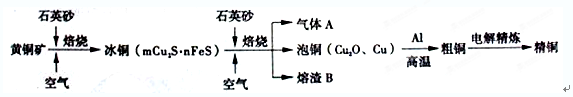
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1  2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1 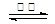 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过煤的直接或间接液化可以获得各种芳香烃 |
| B.通过石油的催化重整等工艺可获取芳香烃 |
| C.石油的裂化的目的主要是为了提高轻质油的产量 |
| D.石油的裂解的目的主要是为了获取不饱和烯烃 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常用石油的年产量来衡量一个国家的石油化学工业发展水平 |
| B.酸雨的形成主要是汽车排出大量尾气 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.二氧化碳在我国重点城市近年来已发布的“空气质量日报”中不列入首要污染物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |
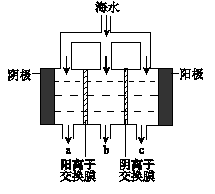
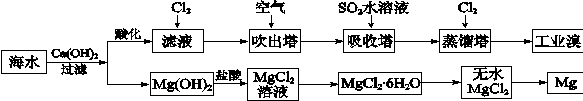
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com