

| ””Mn£ØOH£©2 | Fe£ØOH£©2 | Fe£ØOH£©3 | ””Cu£ØOH£©2 | |
| ””æŖŹ¼³Į¶ØŹ± | ””8.3 | ””7.6 | ””2.7 | ””6.7 |
| ””ĶźČ«³ĮµķŹ± | ””9.8 | ””9.6 | ””3.7 | 9 |
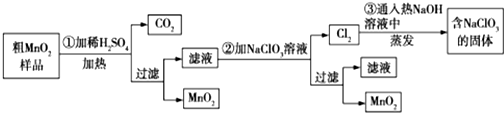
·ÖĪö ĮāĆĢæóÓĆĻ”ĮņĖįĖį½ž£¬MnCO3”¢FeCO3”¢Cu2£ØOH£©2CO3ÓėĻ”ĮņĖį·“Ó¦£¬SiO2²»ÓėĻ”ĮņĖį·“Ó¦£¬¹żĀĖµĆµ½ĀĖŌü1ĪŖSiO2£¬ĀĖŅŗ1ÖŠŗ¬ÓŠĀČ»ÆĆ¾”¢ĀČ»ÆŃĒĢś”¢ĀČ»ÆĶ¼°Ź£ÓąµÄHCl£¬ĻņĀĖŅŗÖŠ¼ÓČėŹŌ¼ĮaĪŖøßĆĢĖį¼Ų£¬½«ČÜŅŗÖŠFe2+Ńõ»ÆĪŖFe3+£¬¼ÓČėŹŌ¼ĮbĪŖĢ¼ĖįĆĢ”¢Mn£ØOH£©2µČµ÷½ŚPH=4Ź±Fe3+×Ŗ»ÆĪŖFe£ØOH£©3³Įµķ£¬¹żĀĖ³żČ„£¬ĀĖŅŗ2ÖŠ¼ÓČėŹŌ¼ĮcĪŖMnS£¬½«ČÜŅŗÖŠCu2+Ńõ»ÆĪŖCuS³Įµķ¹żĀĖ³żČ„£¬ĀĖŅŗ3ÖŠĪŖMnCl2£¬×īŗó¾µē½āµĆµ½KMnO4£®
£Ø1£©¶žŃõ»Æ¹čæÉÓĆÓŚ½ØÖž”¢ĘĢĀ·»ņÉś³É¹čĖįŃĪµČ£»½«³Įµķ·ÅŌŚ¹żĀĖĘ÷ÖŠ£¬Ė®½žĆ»³Įµķ×ŌČ»Į÷ĻĀ£»
£Ø2£©ŹŌ¼Įa½«ČÜŅŗÖŠFe2+Ńõ»ÆĪŖFe3+£¬ĒŅ²»ÄÜŅżČėŠĀŌÓÖŹ£»
£Ø3£©ŹŌ¼Įbµ÷½ŚpHŹ¹ĢśĄė×Ó×Ŗ»ÆĪŖ³Įµķ£¬µ«²»ÄÜŅżČėŠĀŌÓÖŹ£»
£Ø4£©·¢Éś³ĮµķµÄ×Ŗ»Æ£»
£Ø5£©ÓÉĢāŅāæÉÖŖ£¬Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬ĆĢĄė×ÓŹ§Č„µē×Ó£»ÓĆĀČ»ÆĆ¾Ź±µē½āĀČĄė×ӷŵēÉś³ÉĀČĘų£»
£Ø6£©øł¾Ż¹ŲĻµŹ½5Fe2+”«MnO4-¼ĘĖć25.00mLµÄĀĖŅŗ1ÖŠFe2+µÄĪļÖŹµÄĮ棬ŌŁøł¾ŻFe2+µÄÅضČ=$\frac{nM}{V}$¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»Æ¹čæÉÓĆÓŚ½ØÖž”¢ĘĢĀ·»ņÉś³É¹čĖįŃĪµČ£»Ļ“µÓĀĖŌü1µÄ¾ßĢå²Ł×÷·½·ØĪŖ½«³Įµķ·ÅŌŚ¹żĀĖĘ÷ÖŠ£¬Ė®½žĆ»³Įµķ×ŌČ»Į÷ĻĀ£¬ÖŲø“2”«3“Ī£¬
¹Ź“š°øĪŖ£ŗ½ØÖž²ÄĮĻ£»½«³Įµķ·ÅŌŚ¹żĀĖĘ÷ÖŠ£¬Ė®½žĆ»³Įµķ×ŌČ»Į÷ĻĀ£¬ÖŲø“2”«3“Ī£»
£Ø2£©ŹŌ¼Įa½«ČÜŅŗÖŠFe2+Ńõ»ÆĪŖFe3+£¬ĒŅ²»ÄÜŅżČėŠĀŌÓÖŹ£¬Ö»ÓŠøßĆĢĖį¼Ų·ūŗĻ£¬
¹Ź“š°øĪŖ£ŗB£»
£Ø3£©ŹŌ¼Įbµ÷½ŚpHŹ¹ĢśĄė×Ó×Ŗ»ÆĪŖ³Įµķ£¬µ«²»ÄÜŅżČėŠĀŌÓÖŹ£¬Ōņ¼ÓČėŹŌ¼ĮbĪŖĢ¼ĖįĆĢ”¢Mn£ØOH£©2µČ£¬
¹Ź“š°øĪŖ£ŗCD£»
£Ø4£©MnSÓėĀČ»ÆĶ·“Ó¦×Ŗ»ÆøüÄŃČܵÄCuS£¬Ķ¬Ź±µĆµ½ĀČ»ÆĆ¾£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖMnS+Cu2+=Mn2++CuS£¬
¹Ź“š°øĪŖ£ŗMnS+Cu2+=Mn2++CuS£»
£Ø5£©ÓƶčŠŌµē¼«µē½āĮņĖįĆĢŗĶĮņĖį¼Ų»ģŗĻČÜŅŗµÄ·½·ØæÉŅŌÖĘČ”øßĆĢĖį¼Ų£¬µē½āŹ±µÄŃō¼«·“Ó¦Ź½ĪŖMn2+-5e-+4H2O=8H++MnO4-£®¹¤ŅµÉĻÓĆĮņĖįČܽāĢ¼ĖįĆĢ£¬¶ų²»ÓĆŃĪĖįČܽā£¬ĘäŌŅņŹĒĀČĄė×ӷŵēÉś³ÉÓŠ¶¾ĘųĢåĀČĘų£¬
¹Ź“š°øĪŖ£ŗMn2+-5e-+4H2O=8H++MnO4-£»ĀČĄė×ӷŵēÉś³ÉÓŠ¶¾ĘųĢåĀČĘų£»
£Ø6£©øßĆĢĖį¼ŲÓėFe2+µÄ·“Ó¦ŹĒMnO4-”«Mn2+”«5e-£»Fe2+”«Fe3+”«e-£»ŅĄ¾Żµē×ÓŹŲŗć£¬ĢśĄė×ÓŗĶŃĒĢśĄė×ÓĒ°³Ė5£¬ŅĄ¾ŻŌ×ÓŹŲŗćŗĶµēŗÉŹŲŗćµĆµ½·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗMnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O£»Éč25.00mLµÄĀĖŅŗ1ÖŠFe2+µÄĪļÖŹµÄĮæxmol£¬Ōņ£ŗ
5Fe2+”«”«”«”«”«”«MnO4-£¬
5 1
xmol 0.02L”Į0.1000mol/L ĖłŅŌx=0.01mol£¬ŌņĀĖŅŗ1ÖŠFe2+µÄÅضČĪŖ$\frac{0.01mol”Į56g/mol}{0.025L}$=22.4g/L£¬
¹Ź“š°øĪŖ£ŗ22.4£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļ·ÖĄėĢį“æ¼°ĪļÖŹÖʱøŹµŃ飬ĪŖøßĘµæ¼µć£¬°ŃĪÕŹµŃéĮ÷³ĢÖŠµÄ·“Ó¦”¢»ģŗĻĪļ·ÖĄėĢį“攢µē½āŌĄķĪŖ½ā“š µÄ¹Ų¼ü£¬×ŪŗĻŠŌ½ĻĒ棬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬ĢāÄæÄѶČÖŠµČ£®


 ¶į¹Ś½š¾ķČ«ÄÜĮ·æ¼ĻµĮŠ“š°ø
¶į¹Ś½š¾ķČ«ÄÜĮ·æ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ³ĮµķĪļ | Fe£ØOH£©3 | Al£ØOH£©3 | Fe£ØOH£©2 | Mg£ØOH£©2 | Mn£ØOH£©2 |
| æŖŹ¼³Įµķ | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| ĶźČ«³Įµķ | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ½šŹōĄė×Ó | æŖŹ¼³ĮµķµÄpH | ³ĮµķĶźČ«µÄpH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ö²ĪļµÄ¹āŗĻ×÷ÓĆŹ¹µĆĢ«ŃōÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ | |
| B£® | ČĖĄąŹ¹ÓĆÕÕĆ÷Éč±øŹĒ½«µēÄÜ×Ŗ»ÆĪŖ¹āÄÜ | |
| C£® | »Æѧ¼üµÄ¶ĻĮŃŗĶŠĪ³ÉŹĒ»Æѧ·“Ó¦ÖŠÄÜĮæ±ä»ÆµÄÖ÷ŅŖŌŅņ | |
| D£® | Č¼ĮĻČ¼ÉÕŹ±Ö»ŹĒ½«»ÆѧÄÜ×Ŗ»ÆĪŖČČÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com