
高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。
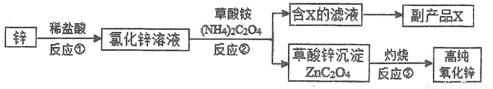
(1)反应①的化学方程式为___________________。
(2)反应②的基本反应类型是_____________。
(3)副产品X的化学式为:______________。从含X的滤液中获取固体X的实验操作步骤是:___________、____________、过滤。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_________、________。
(5)若用纯度为97.5%的1kg粗锌制备高纯氧化锌,理论上最多可生产出氧化锌的物质的量为:_________mol。
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁铝合金5.1 g溶于300 mL 2 mol·L-1的盐酸中,在标准状况下放出气体的体积为5.6 L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
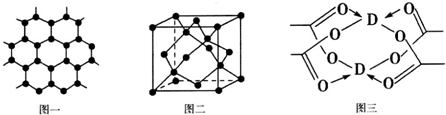
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
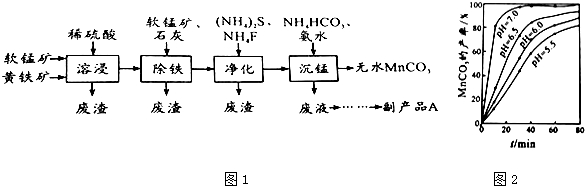
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
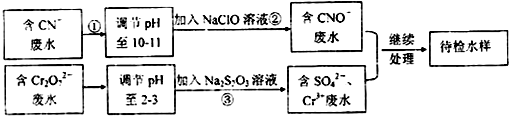
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X分别和其他四种元素均可形成至少2种化合物 | |
| B. | M、W、X、Y、Z的原子半径由大到小的顺序为Y>Z>X>W>M | |
| C. | X气态氢化物的稳定性大于Z态氢化物,但是X气态氢化物的沸点小于Z气态氢化物 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com