
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
分析 ①含有离子键的化合物是离子化合物,离子化合物也可能含共价键;
②只含共价键的化合物是共价化合物;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
⑤由分子组成的物质中不一定存在共价键,但一定存在分子间作用力;
⑥熔融状态能导电的化合物是由离子构成的.
解答 解:①含有离子键的化合物是离子化合物,离子化合物也可能含共价键,如KOH,故正确;
②只含共价键的化合物是共价化合物,含有离子键的化合物是离子化合物,所以共价化合物中一定不含离子键,故错误;
③含金属元素的化合物不一定是离子化合物,可能是共价化合物,如氯化铝,故正确;
④由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故错误;
⑤由分子组成的物质中不一定存在共价键,但一定存在分子间作用力,如稀有气体,故错误;
⑥熔融状态能导电的化合物是由离子构成的,所以属于离子化合物,故正确;
故选D.
点评 本题考查化学键和化合物的关系,侧重考查基本概念及学生判断能力,明确物质的构成微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断化合物类型,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
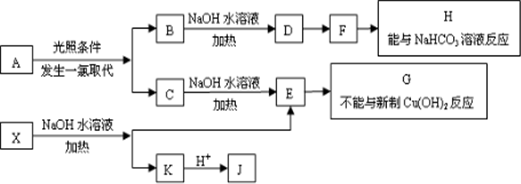
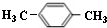 .
.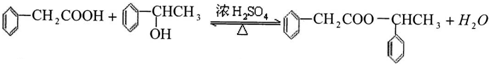 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应).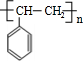 .
.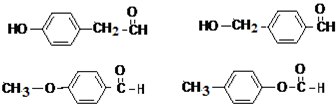 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
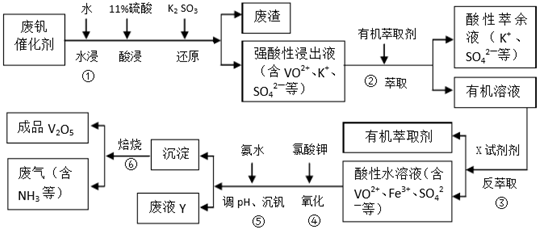
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
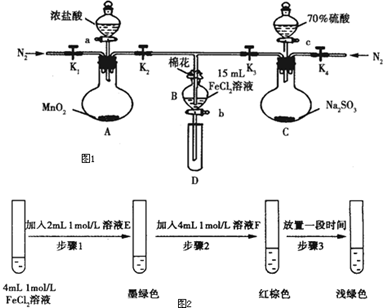
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
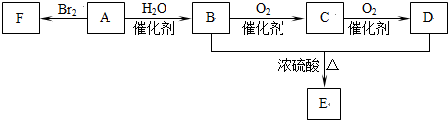
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
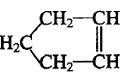 可简写为
可简写为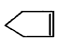 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: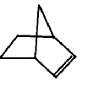
| A. | 易溶于水 | B. | 能发生氧化反应 | C. | 能发生加成反应 | D. | 能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com