
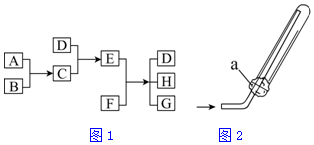
 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如图1所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如图1所示:分析 D与C反应得到E,且C、D为气体,E为固体,故可推知C、D可能为NH3、HCl中一种;E为NH4Cl,再结合E+F→D+H+G,G是氯化钙,进一步推知D为NH3、F为Ca(OH)2、H为H2O,所以C是HCl,A、B分别是H2和Cl2中的一种,据此解答.
解答 解:(1)由以上分析可知,A、B分别是H2和Cl2中的一种,则B在A中燃烧的实验现象为安静地燃烧、产生苍白色火焰、瓶口有白雾,其化学方程式为H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2HCl;故答案为:安静地燃烧、产生苍白色火焰、瓶口有白雾;H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2HCl;
(2)实验室可用C的浓溶液即浓盐酸与一种黑色粉末二氧化锰反应制取A即Cl2,该反应的离子方程式为MnO2+4H+(浓)+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,因为生成1mol氯气转移2mol电子,被氧化的C的物质的量为2mol,所以若反应中转移0.5mol电子,则生成A的体积(标准状况)为$\frac{0.5}{2}$×22.4=5.6L,被氧化的C的物质的量为0.5mol,故答案为:MnO2+4H+(浓)+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;5.6;0.5;
(3)E和F反应生成D、H和G的化学方程式即氯化铵和氢氧化钙的反应为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
①D为NH3,极易溶于水,所以不能用排水法收集,故正确;
②E为NH4Cl,实验室不能用加热NH4Cl分解制氨气,原因生成的氯化氢和氨气又组合成NH4Cl,故错误;
③图中的a为浸有稀H2SO4的棉花,吸收多余的氨气,故正确;
④生石灰与水反应放热,使氨气挥发,所以可以用D的浓溶液和生石灰为原料制取D,故正确;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,①③④.
点评 本题考查无机物的推断,注意利用信息推断各物质是解答的关键,明确氯气的性质及氨气的制法即可解答,实验现象为解答的突破口,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫和氯气都能使品红溶液褪色 | |
| B. | 漂白粉暴露在空气中久置会变质 | |
| C. | 在加热条件下,镁能在二氧化碳气体中燃烧 | |
| D. | 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中加有碘,用其配成的溶液遇淀粉变蓝 | |
| B. | 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 | |
| C. | 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 | |
| D. | 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液产生白色沉淀,一定有Cl- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫单质在过量氧气中燃烧产生NA个SO3分子 | |
| B. | 标准状况下,22.4LSO3中含有氧原子数为3NA | |
| C. | 标准状况下,18gH2O中含有氧原子数为NA | |
| D. | 5.4g铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的原子序数比X的大 | B. | Y的离子半径比X的离子大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11g CO2含有的共用电子对数为0.5NA | |
| B. | 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA | |
| C. | 通常状况下,39 g Na2O2固体中含有的离子总数为2NA | |
| D. | 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com