
| A. | ②③⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①②④⑤ |
分析 ①向饱和Na2CO3溶液中通入过量CO2生成NaHCO3比Na2CO3溶解度小;
②发生Fe(OH)3胶体的聚沉,H2SO4过量时,Fe(OH)3溶解;
③二氧化碳与氯化钡溶液不反应;
④向石灰水中通入过量CO2时,先反应:Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2,CO2过量时,沉淀消失;
⑤生成硫酸钡沉淀.
解答 解:①Na2CO3+H2O+CO2═2NaHCO3,向饱和Na2CO3溶液中通入过量CO2生成NaHCO3,NaHCO3的溶解度比Na2CO3溶解度小,会生成沉淀,NaHCO3通入CO2时不会反应,不发生先沉淀后溶解现象,故①正确;
②因加入少量硫酸,则发生Fe(OH)3胶体的聚沉,故②正确;
③盐酸酸性比碳酸强,二氧化碳与氯化钡溶液不反应,不发生先沉淀后溶解现象,故③错误;
④向石灰水中通入过量CO2时,先反应:Ca(OH)2+CO2═CaCO3↓+H2O,CaCO3+CO2+H2O═Ca(HCO3)2,CO2过量时,沉淀消失,发生先沉淀后溶解现象,故④错误;
⑤发生H++SO42-+Ba2++OH-=BaSO4↓+H2O,生成沉淀,故⑤正确.
故选B.
点评 本题考查较为综合,涉及元素化合物知识,胶体等,为高频考点,侧重考查学生的分析能力,题目难度中等,解答本题的关键是把握物质的性质,注意胶体的性质.


科目:高中化学 来源: 题型:解答题
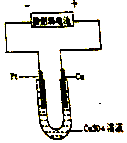 肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定是酸性氧化物 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 分子中含有几个氢原子就是几元酸 | |
| D. | 酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸能测得氯水的pH=4 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| C. | 所有的金属都是固态的 | |
| D. | 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pt是正极 | B. | 负极反应:Zn-2e-═Zn2+ | ||
| C. | 正极反应:2H++2e-═H2↑ | D. | 正极反应:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和 ; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)
; ⑧尿素【CO(NH2)2】和 氰酸铵(NH4CNO)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com