
分析 发生反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,根据n=$\frac{m}{M}$计算碳酸钙物质的量,根据方程式计算氯化钙、HCl、二氧化碳物质的量,由此分析解答.
解答 解:10g CaCO3 的物质的量=$\frac{10g}{100g/mol}$=0.1mol
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 2 1 22.4L
0.1mol n(HCl) n(CaCl2) V(CO2)
n(HCl)=$\frac{0.1mol×2}{1}$=0.2mol,所以需要2mol/L稀盐酸的体积为:$\frac{0.2mol}{2mol/L}$=0.1L=100ml;
n(CaCl2)=$\frac{0.1mol×1}{1}$=0.1mol
V(CO2)=$\frac{0.1mol×22.4L}{1mol}$=2.24L
答:(1)至少需要2mol/L稀盐酸100ml;
(2)生成标准状况下的CO22.24L;
(3)生成CaCl2的物质的量是0.1mol.
点评 本题考查化学方程式的有关计算,比较基础,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
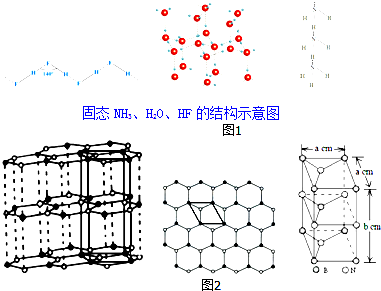
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨在密林中看到一缕缕光束 | |
| B. | 盐酸与硝酸银溶液反应生成白色沉淀 | |
| C. | 豆浆中加入盐卤做豆腐 | |
| D. | 一束平行光射入蛋白质溶液中,侧面可看到一束光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,则方框内的物质为( )
,则方框内的物质为( )| A. | H2S | B. | Na2SO3 | C. | CuSO4 | D. | Cu2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
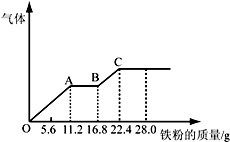 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中NO3-物质的量为0.2mol | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | H2SO4浓度为4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④③ | B. | ②④③① | C. | ②④① | D. | ②③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片做负极,锌发生还原反应 | B. | 铜片做正极,铜得电子 | ||
| C. | 溶液中的pH值减小 | D. | 铜片上有气泡冒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com