
 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.分析 X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质,且Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低,则Z为Cl元素,W为Mn元素;前四周期中基态原子中单电子数最多也即价层电子排布式为3d54s1(单电子数为6),则R为铬元素;X、Y、Z原子序数依次增大,X2-和Y+有相同的核外电子排布,则X为O元素,Y为Na元素;X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质,可知W为Mn元素,据此答题;
解答 解:X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质,且Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低,则Z为Cl元素,W为Mn元素;前四周期中基态原子中单电子数最多也即价层电子排布式为3d54s1(单电子数为6),则R为铬元素;X、Y、Z原子序数依次增大,X2-和Y+有相同的核外电子排布,则X为O元素,Y为Na元素;X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质,可知W为Mn元素,
(1)依据洪特规则可推知前四周期中基态原子中单电子数最多也即价层电子排布式为3d54s1(单电子数为6),则R为铬元素,其基态原子核外电子排布式为[Ar]3d54s1,
故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)Z为Cl元素,同周期上主族的元素为F,氟化氢分子之间有氢键,所以氟化氢的沸点高于氯化氢,
故答案为:氟化氢分子之间有氢键;
(3)O与Cl中电负性较大的是O;Cl的含氧酸盐中用于实验室制取氧气的盐为KClO3,ClO3-的价层电子对数为4(3个σ键、1个孤电子对),故ClO3-的空间构型与NH3相同为三角锥形;ClO3-中Cl、O间为共价键,ClO2中,氯原子按xp3杂化,有两对孤电子对,由于孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力所以O-Cl-O的键角<109°28′,
故答案为:O;三角锥形;共价键;<;
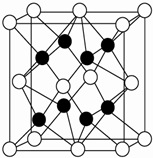
(4)由晶胞结构可知,白球位于顶点和面心,数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑球位于体内,数目为8,则白球代表O2-,黑球代表Na+,O2-位于顶点被8个晶胞共有,即与其距离相等且最近的Na+数目为8,其配位数为8,这8个Na+构成正方体或立方体,由于镁离子半径小于钠离子,所以MgO中晶格能大于Na2O,所以Na2O的熔点小于MgO,
故答案为:8,正方体或立方体;MgO;
(5)利用均摊法可知一个晶胞中含有4个Na2O微粒,故该晶胞的质量为$\frac{4×62}{N{\;}_{A}}$,晶胞体积为a3×10-30cm3,密度为:$\frac{4×62}{{a}^{3}×10{\;}^{-30}×N{\;}_{A}}$g•cm-3,
故答案为:$\frac{4×62}{{a}^{3}×10{\;}^{-30}×N{\;}_{A}}$.
点评 本题考查元素推断、杂化类型、配位数和晶胞密度计算,难度不大,应利用均摊法计算出晶胞中所含微粒数.


科目:高中化学 来源: 题型:选择题
| A. | 乙炔的电子式: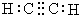 | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | 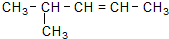 命名为4-甲基-2-戊烯 命名为4-甲基-2-戊烯 | D. | 苯分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═2H2O+Ca2+ | |
| B. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂只有Cu2O | |
| B. | Cu既是氧化产物,又是还原产物 | |
| C. | Cu2S在反应中既是氧化剂又是还原剂 | |
| D. | 还原产物与氧化产物的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2 | B. | Fe、NaCl | C. | Fe(OH)3、NaCl、H2 | D. | H2、NaCl、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na在氧气中完全燃烧所得产物的电子式为
,Na在氧气中完全燃烧所得产物的电子式为

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期的非金属元素,由左到右其氧化物对应水化物的酸性依次递增 | |
| B. | aXn-与bYm+两种离子电子层结构相同,则b-a=n+m | |
| C. | 同一主族非金属元素对应氢化物稳定性依次递增,是由于其相对分子质量依次递增、分子间作用力增强所导致的 | |
| D. | 同一主族非金属元素对应氢化物沸点由上到下依次递增 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com