
 物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题:
物质结构与性质包括原子、分子和晶体结构与性质三大内容.请回答下列问题: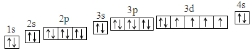 ;第ⅦA族元素原子外围电子排布通式为ns2np5.
;第ⅦA族元素原子外围电子排布通式为ns2np5.| H | B | C | N | O | F |
| 2.18 | 2.04 | 2.55 | 3.04 | 3.44 | 3.98 |
| Si | P | S | Cl | ||
| 1.90 | 2.19 | 2.58 | 3.16 |
 ,能发生加成反应、取代反应(填有机反应类型).
,能发生加成反应、取代反应(填有机反应类型).| 氨 | 三氟化氮 | |
VSEPR模 型 | 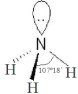 | 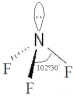 |
| 熔点/℃ | -77.7 | -206.8 |
| 沸点/℃ | -33.5 | -129.0 |
分析 (1)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,结合泡利原理、洪特规则画出核外电子排布图;第ⅦA族元素原子外围电子为7,分别处于ns、np能级中;
(2)在Al、N、O三种元素中,Al为金属元素,第一电离能最小,而N原子2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的;三元素中原子半径最大的元素为Al,离子半径最大的元素为N元素;
(3)①电负性越大,对键合电子吸引越大,化合物中电负性大的元素表现负化合价;
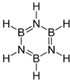
②B3N3H6与苯互为等电子体,二者结构与性质相似;
③氨分子间能形成氢键,且极性比NF3强,而NF3分子间不能形成氢键;
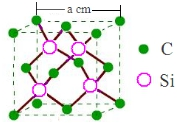
④Si原子与周围4个C原子形成4个键,杂化轨道数目为4,根据均摊法计算晶胞中Si、C原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,核外电子排布图为: ,第ⅦA族元素原子外围电子为7,外围电子排布通式为:,
,第ⅦA族元素原子外围电子为7,外围电子排布通式为:,
故答案为: ;ns2np5;
;ns2np5;
(2)在Al、N、O三种元素中,Al为金属元素,第一电离能最小,而N原子2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的,第一电离能由大到小的排序是:N>O>Al,
三元素中原子半径最大的元素为Al,离子半径最大的元素为N元素,二者组成的物质为AlN,
故答案为:N>O>Al;AlN;
(3)①电负性越大,对键合电子吸引越大,化合物中电负性大的元素表现负化合价,表中H的电负性大于Si、B的,故简单氢化物中H元素表现负化合价为:SiH4、B2H6,
故答案为:SiH4、B2H6;
②B3N3H6与苯互为等电子体,二者结构与性质相似,故B3N3H6的结构式为: ,可以发生加成反应、取代反应,
,可以发生加成反应、取代反应,
故答案为: ;加成反应、取代反应;
;加成反应、取代反应;
③氨分子间能形成氢键,且极性比NF3强,而NF3分子间不能形成氢键,故NF3熔沸点比NH3低很多,
故答案为:氨分子间能形成氢键,且极性比NF3强,而NF3分子间不能形成氢键;
④Si原子与周围4个C原子形成4个键,杂化轨道数目为4,硅原子的杂化类型为sp3,
晶胞中Si原子处于晶胞内部,Si原子数目为4,碳原子处于晶胞顶点与面心,晶胞中C原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{12+28}{{N}_{A}}$g,晶胞棱长为a cm,则晶体密度为4×$\frac{12+28}{{N}_{A}}$g÷(a cm)3=$\frac{160}{{N}_{A}•{a}^{3}}$g/cm3,
故答案为:sp3;$\frac{160}{{N}_{A}•{a}^{3}}$g/cm3.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、等电子体、分子结构与性质、杂化方式判断、晶胞计算等,注意氢键对物质性质的影响,理解同周期主族元素中第一电离能异常原因.


科目:高中化学 来源: 题型:推断题
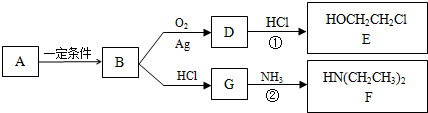
 $\stackrel{还原}{→}$
$\stackrel{还原}{→}$ )
) (甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$
(甲苯)$→_{浓H_{2}SO_{4}}^{浓HNO_{3}}$甲$\stackrel{氧化}{→}$乙$→_{③}^{E}$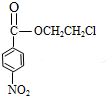 $\stackrel{还原}{→}$丙$→_{④}^{F}$
$\stackrel{还原}{→}$丙$→_{④}^{F}$ (普鲁卡因)
(普鲁卡因)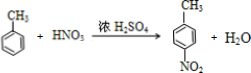 .反应③的化学方程式是(乙中有两种含氧官能团):
.反应③的化学方程式是(乙中有两种含氧官能团):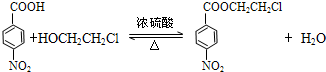 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
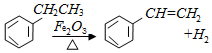 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2、CCl4鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
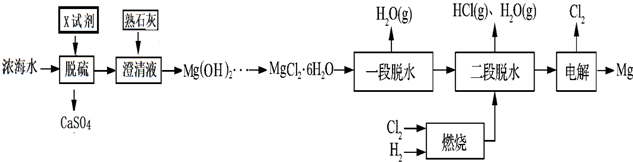
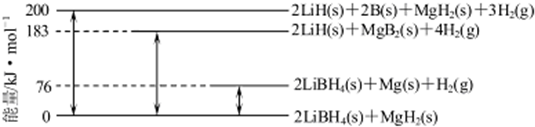
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
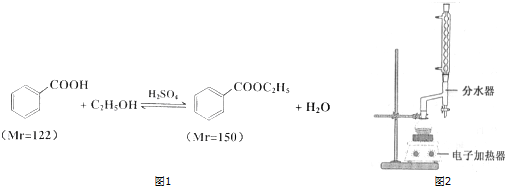
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | 气态氢化物稳定性:Y>T | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | R位于元素周期表中第二周期第VA族 | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 | |
| B. | 铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 | |
| C. | 将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 | |
| D. | 在中性环境中,每生成35.6 g铁锈(Fe2O3•H2O),消耗的氧气为6.72 L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
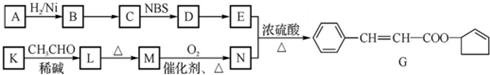
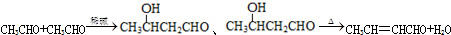
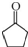 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
.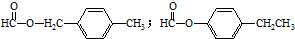 .
.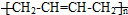 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com