
[化学—物质结构与性质〕(13分)硅、锗、磷化锢、氮化镓、聚丙烯睛都是半导体材料。
(1)基态锗(Ge)原子的核外电子排布式为 。
(2)聚丙烯睛由丙烯睛(CH2=CH-CN)聚合而成。丙烯睛分子中所有原子都在同一平面上,则丙烯睛分子中,碳原子的杂化轨道类型有 ,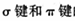 的个数比为 。
的个数比为 。
(3)(CH3)3Ga、(CH3CH2)3Ga是制取氮化稼的常见镓源,常温常压下均为无色透明的液体。下列说法正确的是 (填标号)。
A.(CH3)3Ga晶体属于分子晶体
B.(CH3)3Ga中所含化学键都是极性键
C.(CH3CH2)3Ga晶体中含有氢键
D.(CH3CH2)3Ga中所有原子都达到稀有气体的稳定结构
(4)氮化稼(GaN)的晶体结构如左下图所示。该晶体中 (填“有”或“无”)配位键存在,判断的依据是
(5)上图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是 (填标号)。
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是
A.Fe3+易水解,它的水解产物之一能抑制的Fe2+ 水解
B.Fe2+ 有较强的还原性,它能还原Fe3+
C.Fe3+有较强的氧化性,它能氧化Fe2+
D.Fe3+的水解是吸热反应,升温能促进它的水解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:推断题
(14分)药物F具有抗肿瘤、降血压、降血糖等多种生物活性,其合成路线如下:
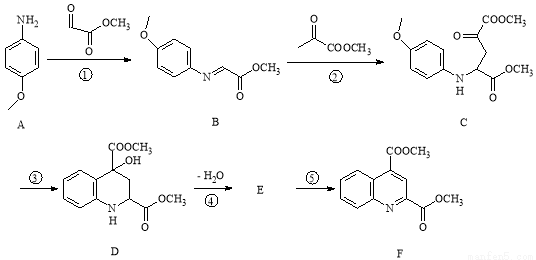
已知: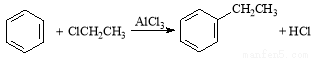
(1)原料A中含氧、含氮的官能团名称是 、 。
(2)写出中间产物E的结构简式 。
(3)反应②、⑤的反应类型是 、 。
(4)物质B有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式 。
①属于α-氨基酸
②苯环上有两种一氯代物
③能发生银镜反应
④核磁共振氢谱显示其有7种不同化学环境的氢原子
(5)以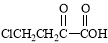 和苯、乙醇为原料,可合成
和苯、乙醇为原料,可合成 ,写出合成流程
,写出合成流程
图(无机试剂任用)。合成流程图示例如下:
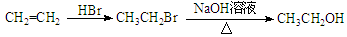
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液。
(1)请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 存在Fe3+ | |
取少量除尽Ag+后的溶液于试管中,加入1~2滴 (填序号)溶液,振荡 | 存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
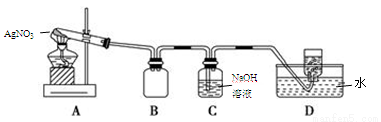
(2)装置B的作用是 。
(3)经小组讨论并验证该无色气体为O2,其操作方法是 。
(4)【查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:①Ag;②Ag2O;③Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
实验编号 | 操 作 | 现 象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为 。
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
镁—次氯酸盐燃料电池,它具有比能量高、安全方便等优点。该电池的正极反应式为:ClO- + H2O + 2e-= Cl- + 2OH-,关于该电池的叙述正确的是
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
D.电池工作时,正极周围溶液的pH将不断变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:选择题
实验室中,从海带中提取I2的实验流程如下图所示,下列说法不正确的是

A.操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗
B.操作②中需加入氧化剂
C.可以用四氯化碳或酒精代替苯作萃取剂
D.蒸馏I2的苯溶液可获取I2并回收苯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:选择题
【化学——选修3:物质结构与性质】(15分)有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是___________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
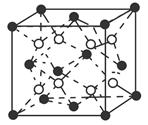
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:实验题
(14分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:

(1)首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
(2)烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
(3)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的 (填仪器名称)起到了确保硫酸体积保持不变的作用。
(4)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
(5)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析: (填“需要”或“不需要”)加入双氧水,原因: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是
C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是

A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动
C.反应过程中A和B的转化率之比为3:1
D.该条件下此反应的化学平衡常数的数值约为0.82
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com