
| ||
| ||
| ||
| ||
| ||
| ||
 ,
, .
.


科目:高中化学 来源: 题型:
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为水的离子积常数的表达式是KW=c(H+)?c(OH-),所以KW随溶液H+和OH-浓度的变化而变化 |
| B、水的离子积常数KW与水的电离平衡常数K电离是同一个物理量 |
| C、水的离子积常数仅仅是温度的函数,随着温度的变化而变化 |
| D、水的离子积常数KW与水的电离平衡常数K电离是两个没有任何关系的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
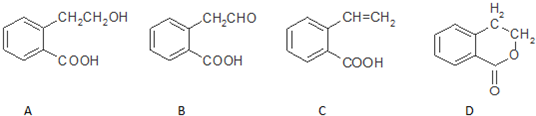
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.据此回答:这里的钙、镁、钾、钠指的是
(1)日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.据此回答:这里的钙、镁、钾、钠指的是| 熔点(℃) | 密度 (g/cm3) | 硬度 (金刚石为10) | 导电性 (银为100) | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)硼酸(H3BO3)溶液中存在如下平衡:
(1)硼酸(H3BO3)溶液中存在如下平衡:| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com