
| A. | 单质硅可用作光导纤维 | |
| B. | 普通玻璃、陶瓷、水泥属于传统无机非金属材料 | |
| C. | 石英晶体是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 水玻璃可用于制备硅胶和木材防火剂的原料 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
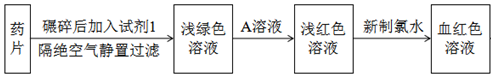
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42- | |
| B. | 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2 Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
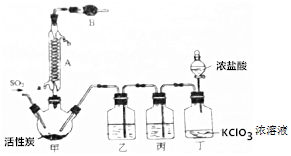
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com