


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年天津卷)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是()
A.V(NaOH)== 0时,c(W)== 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)== 2 c(C2O![]() )+ c(HC2O
)+ c(HC2O![]() )
)
C.V(NaOH)== 10 mL时,c(W)== 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O![]() )>c(HC2O
)>c(HC2O![]() )
)
查看答案和解析>>
科目:高中化学 来源:2012-2013吉林省吉林一中高二下学期期中考试化学试卷(带解析) 题型:单选题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)="=" 0时,c(H+,W)="=" 1 × 10-2 mol/L |
B.V(NaOH)< 10 mL时,不可能存在c(Na+)="=" 2 c(C2O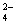 )+ c(HC2O )+ c(HC2O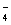 ) ) |
| C.V(NaOH)="=" 10 mL时,c(H+,W)="=" 1 × 10-7mol/L |
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O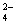 )>c(HC2O )>c(HC2O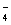 ) ) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第四次阶段测试化学试卷(解析版) 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L( )
B.V(NaOH)<10 mL时,不可能存在c(Na+)=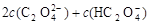
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时, c(Na+)> c(C2O42-)> c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期第一学段考试化学试卷 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com