
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA
B. 1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA
C. 2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA
D. 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.005
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是
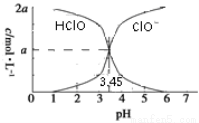
A.当pH=2时,溶液中c(ClO-)>c(Na+)
B.当c(ClO-)>c(HClO)时,溶液一定呈碱性
C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应
D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:实验题
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
金属离子 | 开始沉淀 | 沉淀完全 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:
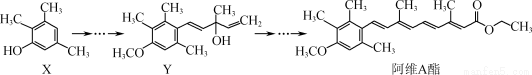
下列叙述正确的是( )
A. 有机物X与Y互为同系物
B. 有机物Y与阿维A酯均能与NaOH溶液反应
C. 一定条件下1 mol阿维A酯能与4 mol H2发生加成反应
D. X中有6种化学环境不同的氢原子,Y中有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )
A.甲基的电子式: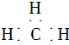
B.镁离子的结构示意图:
C.质量数为34、中子数为18的核素: S
S
D.乙酸的结构简式:
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
有关甲烷和乙烷的说法中,错误的是
A.互为同系物
B.均不能使高锰酸钾酸性溶液褪色
C.在核磁共振氢谱图(1H核磁共振谱图)中,均只有1个吸收峰
D.二氯取代物均为两种
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中各微粒的浓度关系正确的是
 A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液,
A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液,
c (NH4+)的大小顺序为:①>②>③
B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—)
C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3)
D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶N液等体积混合: c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—)
c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:实验题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H=a kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H=b kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示:
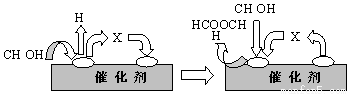
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。

⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com