
含有6个碳原子的烷烃,经催化裂化可生成的烷烃最多有( )
A.3种 B.4种
C.5种 D.6种
科目:高中化学 来源: 题型:
下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙酸的叙述中,不正确的是( )
A.乙酸分子式是C2H4O2,有4个氢原子,不是一元酸
B.乙酸是具有强烈刺激性气味的液体
C.乙酸易溶于水和乙醇
D.鉴别乙酸和乙醇的试剂可以是碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源。已知制酒精的方法有三种:
①在催化剂作用下乙烯与水反应;
②CH3CH2Br+H2O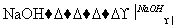 CH3CH2OH+HBr;
CH3CH2OH+HBr;
③(C6H10O5)n(淀粉)+nH2O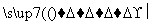 nC6H12O6(葡萄糖);
nC6H12O6(葡萄糖);
C6H12O6(葡萄糖)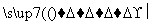 2C2H5OH+2CO2↑。
2C2H5OH+2CO2↑。
(1)方法①的化学方程式是________________________________________。
(2)方法②的化学反应类型是____________。
(3)为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?请简述理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是________。
A.① B.③
C.①③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于物理变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯制备聚乙烯 ⑥将氧气转化为臭氧 ⑦乙烯催熟果实 ⑧将苯加入溴水中 ⑨海水蒸馏制取淡水
A.①②③④ B.①②⑤⑦
C.①⑧⑨ D.①②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
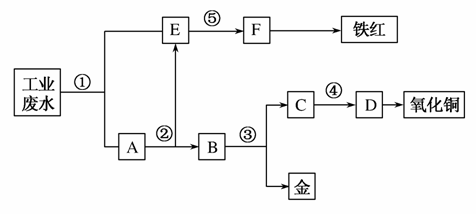
填写下面空白。
(1)图中标号处需加入的相应物质分别是①________;②________;③________;④________;⑤________。
(2)写出①处发生反应的离子方程式_____________________ _____________;写出③处发生反应的化学方程式___________。
(3)铁红的化学式为________________________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________;氧化铜________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中c(Cl-)与50 mL 1 mol·L-1的AlCl3溶液中c(Cl-)相等的是( )
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 CaCl2溶液
C.150 mL 3 mol·L-1 KCl溶液
D.75 mL 3 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中现用Fe与盐酸反应制取2.24 L H2(标准状况下)。
(1)消耗Fe的物质的量为多少?
(2)如果选用所贴标签为2.0 mol·L-1的盐酸,至少需该盐酸多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图所示装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。
(1)写出负极的电极反应式:________________________。
(2)某学生认为,铁电极可能参与反应,并对产物做出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:____________________________________________________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是____________________________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施:________。
Ⅱ.利用如图所示装置做电解50 mL 0.5 mol/L的CuCl2溶液实验。
实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO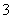 );
);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:
①_________________________________________________________;
②_________________________________________________________。
(2)分析实验记录B中浅蓝色固体可能是________(写化学式),试分析生成该物质的原因:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com