金属钠和铝共0.05mol,放入足量的水中充分反应,产生的气体在标准状况下的体积为784mL,写出反应的化学方程式并计算钠和铝物质的量之比.
解:生成氢气的物质的量为:n(H
2)=
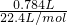
=0.035mol,
发生反应的方程式为:2Na+2H
2O=2NaOH+H
2↑; 2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
设Na为xmol,为Alymol,
(1)当Na过量时:
2Na+2H
2O=2NaOH+H
2↑
2 1
x 0.5x
2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑
2 3
y 1.5y
则有:
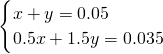
解之得:
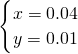
,
即:n(Na):n(Al)=4:1,
(2)当Al过量时:
2Na+2H
2O=2NaOH+H
2↑
2 2 1
x 0.5x
2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑
2 2 3
x x 1.5x
则有:0.5x+1.5x=0.035
x=0.0175
所以:n(Al)=0.05-0.0175=0.00325(mol),
即:n(Na):n(Al)=0.0175:0.0325=7:13,
答:反应的方程式为2Na+2H
2O=2NaOH+H
2↑、2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑;钠和铝的物质的量之比为4:1或7:13.
分析:生成氢气的物质的量为:n(H
2)=
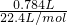
=0.035mol,发生反应的方程式为:2Na+2H
2O=2NaOH+H
2↑;
2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,根据反应的方程式列方程组讨论计算.
点评:本题考查混合物的计算,题目难度中等,注意从过量的角度分两种情况讨论计算.

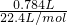 =0.035mol,
=0.035mol,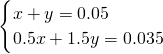
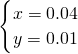 ,
,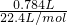 =0.035mol,发生反应的方程式为:2Na+2H2O=2NaOH+H2↑;
=0.035mol,发生反应的方程式为:2Na+2H2O=2NaOH+H2↑;
