
【题目】下列原子半径由小到大排列顺序正确的是( )
A.O、S、NaB.Mg、P、ClC.Cl、Na、FD.S、N、C
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:

写出酸浸的主要化学方程式:______________________。
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上

③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥500mL容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现有质量分数为98%、密度为1.84gcm﹣3 的浓硫酸,该浓硫酸的浓度为mol/L.若需要配制500mL 1molL硫酸溶液,需用98%的浓硫酸mL.
(2)定容时加蒸馏水至距刻线处改用加水使溶液的凹液面正好与刻线相平.
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填写“偏高”“偏低”或“无影响”) ①用以稀释硫酸的烧杯未洗涤
②未经冷却趁热将溶液注入容量瓶
③容量瓶中原有少量的蒸馏水
④定容时观察液面俯视 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酰胺(H2C=CH—CONH2)具有致癌性和遗传毒性。丙烯酰胺主要是由高碳水化合物、低蛋白质的植物性食物在加热(120 ℃以上)过程中形成,特别在烘烤、油炸时更易形成。丙烯酰胺可以进一步形成在工业上有用的聚丙烯酰胺类物质。
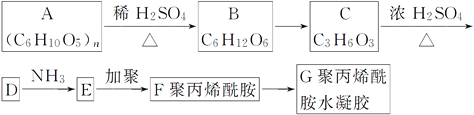
回答下列问题:
(1)D的结构简式为______________;F的结构简式为______________。
(2)指明下列反应类型:A→B____________________,C→D______________________。
(3)丙烯酰胺有多种同分异构体,写出分子中同时含有醛基和碳碳双键的同分异构体:______________________。
(4)写出化学方程式D→E:__________________________________________。2分子C在浓硫酸作用下可形成一个六元酯环,该反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2NA
C.标准状况下,11.2LH2O 含有的分子数为0.5NA
D.在常温常压下,44gCO2含有的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
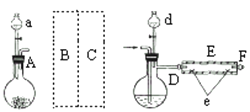
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图的反应路线及所给信息填空:


(1)A的结构简式是_____________。
(2)③的反应类型是______________。
(3)反应④的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )

A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A. 将纯水加热到95℃时,Kw变大,pH不变,水仍呈中性
B. 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C. 向纯水中加入少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离
D. 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com